
 某化学课外活动小组从实验室取出硫酸试剂,试剂瓶上标签的部分内容如图所示.该小组欲配制450mL 0.4mol?L-1的稀硫酸溶液:
某化学课外活动小组从实验室取出硫酸试剂,试剂瓶上标签的部分内容如图所示.该小组欲配制450mL 0.4mol?L-1的稀硫酸溶液:| 1000ρω |
| M |
| n |
| V |
| 1000×1.84×98% |
| 98 |
| 0.448L |
| 22.4L |
| 0.02mol×2 |
| 0.1L |
| n |
| V |


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
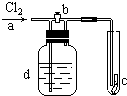 如图,a处通入Cl2,当打开b阀时,c处的干燥的红布条没有明显变化,当关闭b阀时,c处的干燥红布条逐渐褪色,则d瓶中装的溶液可能是( )
如图,a处通入Cl2,当打开b阀时,c处的干燥的红布条没有明显变化,当关闭b阀时,c处的干燥红布条逐渐褪色,则d瓶中装的溶液可能是( )| A、NaOH溶液 |
| B、浓H2SO4 |
| C、Ca(OH)2溶液 |
| D、食盐水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①、② | B、①、③ |
| C、②、④ | D、②、③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
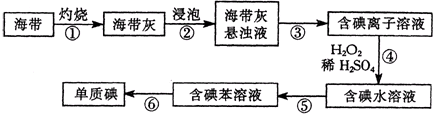
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示是某化学小组根据教材知识设计,说明Na2CO3与NaHCO3热稳定性的套管实验.下列叙述中不正确的是( )
如图所示是某化学小组根据教材知识设计,说明Na2CO3与NaHCO3热稳定性的套管实验.下列叙述中不正确的是( )| A、甲为NaHCO3,乙为Na2CO3 |
| B、要证明NaHCO3受热能产生水,可在小试管内放置沾有少量无水硫酸铜粉末的棉花球 |
| C、加热不久就能看到A烧杯中的澄清石灰水变浑浊 |
| D、整个实验过程中A烧杯中的澄清石灰水无明显变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
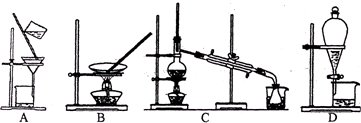
| A、集气瓶、水槽、药匙、量筒、玻璃棒 |
| B、托盘天平、大试管、玻璃棒、胶头滴管 |
| C、烧杯、容量瓶、玻璃棒、量筒、胶头滴管 |
| D、烧瓶、量筒、胶头滴管、玻璃棒、烧杯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、中和时所需氢氧化钠的物质的量 |
| B、H+的物质的量浓度 |
| C、电离平衡常数K |
| D、H+的物质的量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com