
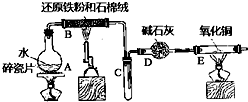
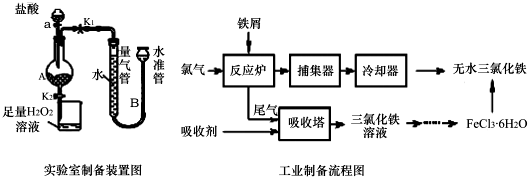
 某实验小组利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3•6H2O晶体.(图中夹持及尾气处理装置均已略去)请回答下列问题:
某实验小组利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3•6H2O晶体.(图中夹持及尾气处理装置均已略去)请回答下列问题:分析 (1)Fe与水蒸气反应生成Fe3O4和H2;碱石灰能干燥气体;
(2)装置E中红色的氧化铁被氢气还原成黑色的铁,同时有水珠生成;
(3)①Fe3+的检验方法是:取少量滤液,滴入几滴硫氰化钾溶液,观察溶液是否变红色;
②向体系中加入铁粉,如果铁粉不溶解,说明不存在Fe3+;
③滤液中FeCl2完全氧化为FeCl3,选择氧化剂能氧化亚铁离子且不引入新的杂质;
④在③所得溶液浓缩结晶前需要用实验证明FeCl2已完全氧化的方法是检验亚铁离子的存在,可以选择高锰酸钾溶液检验.
解答 解:(1)Fe与水蒸气反应生成Fe3O4和H2,反应的化学方程式是3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$ Fe3O4+4H2,
故答案为:3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$ Fe3O4+4H2;
(2)装置B铁与水蒸气反应生成的氢气,经碱石灰干燥后加入装置E,氧化铜与氢气加热发生反应生成了铜和水,所以反应的现象为:黑色的粉末变成紫红色,管壁产生水珠,
故答案为:黑色的粉末变成紫红色,管壁产生水珠;
(3)①Fe3+的检验方法是:取少量滤液,滴入几滴硫氰化钾溶液,观察溶液是否变红色,
故答案为:KSCN溶液;向溶液里滴加KSCN溶液,溶液变血红色;
②向体系中加入铁粉,如果铁粉不溶解,说明不存在Fe3+,所以离子反应方程式为:Fe+2Fe3+=3Fe2+,
故答案为:Fe+2Fe3+=3Fe2+;
③滤液中FeCl2完全氧化为FeCl3,
A.酸性KMnO4溶液 能氧化氯化亚铁,但引入钾离子、锰离子等,故A错误;
B.Cl2 氧化氯化亚铁为氯化铁,不引入新的杂质,故B正确;
C.Na2O2 和水反应生成氢氧化钠,沉淀亚铁离子和铁离子,不能除去,故C错误;
D.FeCl3 不能氧化氯化亚铁,故D错误;
故答案为:B;
④在③所得溶液浓缩结晶前需要用实验证明FeCl2已完全氧化,实验方法是:用小试管取用③反应后的溶液1-2ml,滴入几滴酸性高锰酸钾溶液,溶液不褪色则证明氯化亚铁已被全部氧化,
故答案为:用小试管取用③反应后的溶液1-2ml,滴入几滴酸性高锰酸钾溶液,溶液不褪色则证明氯化亚铁已被全部氧化;
点评 本题考查物质的性质实验,为高考常见题型,侧重于学生的分析能力和实验能力的考查,注意把握实验的原理和操作注意事项,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{53}^{131}{I}$的原子核内中子数多于质子数 | |
| B. | ${\;}_{53}^{131}{I}$的原子序数为131 | |
| C. | ${\;}_{53}^{131}{I}$的原子核外电子数为78 | |
| D. | ${\;}_{53}^{131}{I}$的化学性质与${\;}_{53}^{127}{I}$不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由 1 mol CuFeS2 生成 1mol Cu,共消耗 2.75 molO2 | |
| B. | 该冶炼方法中产生大量的有害气体SO2,可回收用于制备硫酸 | |
| C. | 在反应③中,Cu2S既是氧化剂,又是还原剂 | |
| D. | 在反应①中,SO2既是氧化产物,又是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
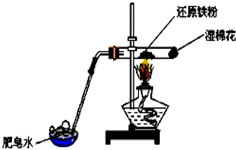
| A. | 实验时,试管口应高于试管底 | |
| B. | 加热时试管内铁粉红热,点燃肥皂泡可听到爆鸣声 | |
| C. | 反应的化学方程式为:2Fe+3H2O(g) $\frac{\underline{\;\;△\;\;}}{\;}$ Fe2O3+3H2 | |
| D. | 实验结束后如果固体仍为黑色,说明原反应没有发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
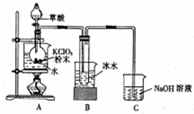 二氧化氯是一种高效消毒剂,在60℃时用氯酸钾与草酸反应可生成二氧化氯,实验装置如图所示:
二氧化氯是一种高效消毒剂,在60℃时用氯酸钾与草酸反应可生成二氧化氯,实验装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.
Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.| 滴定次数 | 滴定前读数(mL) | 滴定滴定后读数(mL) |
| 第一次 | 0.00 | 30.82 |
| 第二次 | 0.00 | 30.80 |
| 第三次 | 0.00 | 30.78 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 0 | 20 | 80 | 100 |
| 溶解度(g/100g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com