
【题目】科学家正在研究开发新的能源,如核能、太阳能、风能、地热、潮汐热等。“绿色能源”是目前正在研究的新能源之一,把高粱、玉米等绿色植物的种子经发酵、蒸馏就可以得到“绿色能源”中的一种。这种物质是
A.氢气 B.甲烷 C.酒精 D.木炭
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
【题目】某简单微粒核外有18个电子,下列关于该微粒的说法正确的是( )
A.该微粒一定具有氧化性B.该微粒一定具有还原性
C.该微粒一定既无氧化性又无还原性D.该微粒可能有氧化性,也可能有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z 的原子序数依次增大,W与Y、X与Z 位于同一主族。W 与X 可形成共价化合物WX2.Y原子的内层电子总数是其最外层电子数的2.5 倍。下列叙述中不正确的是
A. WX2分子中所有原子最外层都为8 电子结构
B. 简单气态氢化物的沸点W的比X的低
C. WX2是以极性键结合成的非极性分子
D. 原子半径大小顺序为X <W<Y<Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用软锰矿制备高锰酸钾,主要实验步骤如下:
步骤一:将软锰矿(主要成分为MnO2)、KClO3和KOH固体按一定比例混合后强热可制得绿色K2MnO4;
步骤二:将反应后固体充分溶解、过滤,向滤液中通入过量CO2气体使溶液显酸性,K2MnO4在酸性条件下反应得到KMnO4、MnO2和K2CO3,最后分离得到高锰酸钾晶体。
请回答下列问题:
(1)请写出步骤一的化学方程式____________________________,此反应不能用瓷坩埚,原因是(用化学方程式表示)_________________________________;
(2)否用浓盐酸代替步骤二中的CO2 ,请简要分析原因__________________________;
(3)部分化合物的溶解度随温度的变化如下表所示,从步骤二反应后的混合溶液中分离得到高锰酸钾晶体的方法是蒸发浓缩、_____________,过滤、洗涤、烘干。为进一步增加得到的产品(高锰酸钾晶体)的纯度,常采用的实验方法是____________;
一些化合物的溶解度S/g(100g H2O)-1
0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
KCl | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 |
K2CO3 | 51.3 | 52.0 | 52.5 | 53.2 | 53.9 | 54.8 |
KMnO4 | 2.83 | 4.4 | 9.0 | 12.7 | 16.9 | 22.2 |
(4)按以上方法制备高锰酸钾,每3 mol K2MnO4彻底反应理论上生成_________mol KMnO4;为增大锰酸钾的原子利用率,更好的制备方法是电解法。以K2MnO4溶液为电解液,采用惰性电极电解,当阴极在标准状况下产生5.6 L H2时,产生KMnO4的物质的量是________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将2molSO2和1molO2置于10L密闭容器中发生反应:2SO2(g)+O2(g) ![]() 2SO3(g);ΔH<0,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )
2SO3(g);ΔH<0,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )
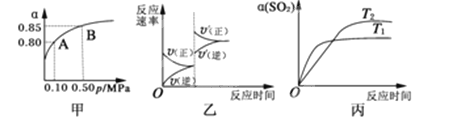
A. 由图甲推断,B点SO2的平衡浓度为0.3 mol·L-1
B. 由图甲推断,A点对应温度下该反应的平衡常数为800(L·mol-1)
C. 达平衡后,若增大容器容积,则反应速率变化图像可以用图乙表示
D. 压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草衍义》中对精制砒霜过程有如下描述:“取砒之法,将生砒就置火上,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之。”文中涉及的混合物分离的操作方法是( )
A. 升华 B. 蒸发 C. 蒸馏 D. 萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1 mol I2(g)和2 mol H2置于某2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g) ![]() 2HI(g)ΔH<0,并达到平衡。HI的体积分数w(HI)随时间t变化如图曲线(Ⅰ)所示。
2HI(g)ΔH<0,并达到平衡。HI的体积分数w(HI)随时间t变化如图曲线(Ⅰ)所示。
(1)达到平衡时,I2(g)的物质的量浓度为______________mol·L-1。
(2)若改变反应条件,在甲条件下w(HI)的变化如图曲线(Ⅱ)所示,在乙条件下w(HI)的变化如图曲线(Ⅲ)所示。则甲条件可能是______________,乙条件可能是______________。(填入下列条件的序号)
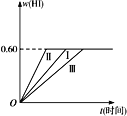
①恒容条件下,升高温度 ②恒容条件下,降低温度 ③恒温条件下,缩小反应容器体积 ④恒温条件下,扩大反应容器体积 ⑤恒温恒容条件下,加入适当催化剂
(3)若保持温度不变,在另一相同的2L密闭容器中加入a mol I2(g),b mol H2(g)和c molHI(g)(a、b、c均大于0),发生反应,达平衡时,HI的体积分数仍为0.60,则a、b、c的关系是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20 mL HCl和H2SO4的混合溶液中逐滴加入0.1 mol·L-1的Ba(OH)2溶液,生成沉淀的质量和溶液的pH与加入的Ba(OH)2溶液体积的关系如图5所示。试完成下列问题:
 图5
图5
(1)起始时,混合酸中硫酸的物质的量浓度为______________ mol·L-1。
(2)起始时,混合酸中盐酸的物质的量浓度为______________ mol·L-1。
(3)B点表示的沉淀的质量为______________g。
(4)A点表示溶液中的c(H+)为______________ mol·L-1,pH为______________。
(5)C点的pH为______________(pH可直接用对数表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com