

 ��MnCl2+Cl2��+2H2O��������һ���ж������壬���йص�ʵ��ʱҪ����β��������һ���ü�Һ���ն����������
��MnCl2+Cl2��+2H2O��������һ���ж������壬���йص�ʵ��ʱҪ����β��������һ���ü�Һ���ն���������� ��MnCl2+Cl2��+2H2O�����ն�����������ֹβ��������
��MnCl2+Cl2��+2H2O�����ն�����������ֹβ��������


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�



�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012��ɽ��ʡΫ���и�����ѧ����ĩ���Ի�ѧ�Ծ� ���ͣ�ʵ����
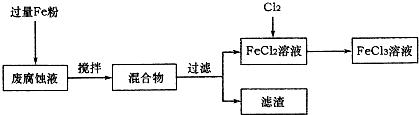
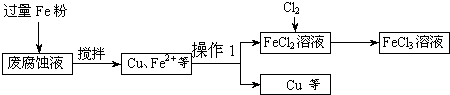
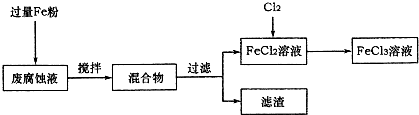
(16��)ӡˢ��·�ķϸ�ʴҺ���д���CuCl2��FeCl2��FeCl3�������ŷŽ����»�����Ⱦ����Դ���˷ѣ��ɴӸ÷�Һ�л���ͭ���������Ļ�����ȫ��ת��ΪFeCl3��Һ����Ϊ��ʴҺԭ��ѭ��ʹ�á�
(1)���ij�ϸ�ʴҺ�к�CuCl2 1.5 mol��L-1��FeCl23.O mol��L-1��FeCl3 1.0 mol��L-1��HCl3.0 mol��L-1��ȡ�ϸ�ʴҺ200mL������������ʵ���ҽ���ʵ�飺
�ش��������⣺
�ϸ�ʴҺ�м���������ۺ�����Ӧ�����ӷ���ʽΪ ��
�ڼ���ϸ�ʴҺ�к���Fe3+��ʵ������� ��
�����������У������ˡ��õ��IJ����������ձ����������� ��
���������õ���ͭ�����������Լ��� ��
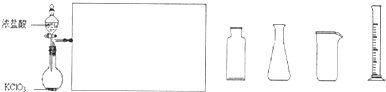
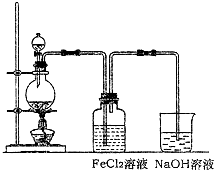
(2)ij��ѧ��ȤС��������ͼװ����ȡ������ͨ�뵽FeCl2��Һ�л��FeCl3��Һ��
��ʵ�鿪ʼǰ��ijͬѧ��ʵ��װ�ý����������Լ�飬������ ��
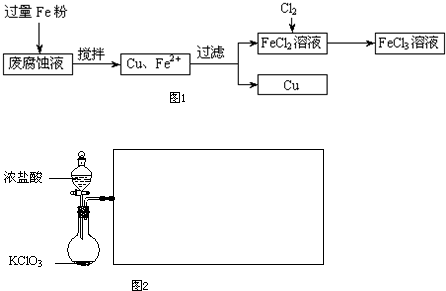
��Ũ������������̷�Ӧ�Ļ�ѧ����ʽΪ ��
�ձ���NaOH��Һ�������� ��
�۲ο�(1)�����ݣ����������̲��������ȡFe�۵�����Ӧ������ g��
��ͨ��Cl2�����ʵ���Ӧ������ mol.
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com