
| A. | 2Cu+O2?2CuO | B. | CH4+2O2 $\frac{\underline{\;点燃\;}}{\;}$ CO2+2H2O | ||
| C. | 2KClO3?2KCl+3O2↑ | D. | CaCO3+2HCl═CaCl2+H2O+CO2↑ |
分析 四大基本反应类型包括化合反应、分解反应、置换反应和复分解反应.
由两种或两种以上的物质反应生成一种物质的反应为化合反应;
一种物质反应生成两种或两种以上的物质的反应为分解反应;
一种单质和一种化合物反应生成另一种单质和另一种化合物的反应为置换反应;
两种化合物相互交换成分生成另外两种化合物的反应为复分解反应.
而氧化还原反应是有电子得失或偏移的反应,据此分析.
解答 解:A、此反应为化合反应,即属于四大基本反应类型,故A错误;
B、此反应不属于四大基本反应类型,但有元素发生化合价的变化,故为氧化还原反应,故B正确;
C、此反应为分解反应,即属于四大基本反应类型,故C错误;
D、此反应为复分解反应,且不是氧化还原反应,故D错误.
故选B.
点评 本题考查了四大基本反应类型和氧化还原反应的判断,应注意的是复分解反应一定不是氧化还原反应.


 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:选择题
| A. | 检验溶液是否含有SO42-时,在无其他阳离子干扰的条件下,先用盐酸酸化,所得溶液再加BaCl2溶液 | |
| B. | 为提高高锰酸钾溶液的氧化能力,用盐酸将高锰酸钾溶液酸化 | |
| C. | 检验溶液中是否含有Fe3+时,用硝酸酸化 | |
| D. | 定性检验SO32-,将BaCl2溶液用HNO3酸化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学反应 | 平衡常数 | 温度 | |
| 973K | 1173K | ||
| ①Fe(s)+CO2(g)?FeO(s)+CO(g)△H1 | K1 | 1.47 | 2.15 |
| ②Fe(s)+H2O(g)?FeO(s)+H2(g)△H2 | K2 | 2.38 | 1.67 |
| ③CO(g)+H2O (g)?CO2(g)+H2(g)△H3 | K3 | ? | ? |
| A. | △H1<0,△H2>0 | |
| B. | 反应①②③的反应热满足关系:△H2-△H1=△H3 | |
| C. | 反应①②③的平衡常数满足关系:K1•K2=K3 | |
| D. | 要使反应③在一定条件下建立的平衡向正反应方向移动,可采取升温措施 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(l);△H1 2H2(g)+O2(g)═2H2O(g);△H2 | |
| B. | S(g)+O2(g)═2SO2(g);△H1 S(s)+O2(g)═2SO2(g);△H2 | |
| C. | C(s)+$\frac{1}{2}$ O2(g)═CO(g);△H1 C(s)+O2(g)═CO2(g);△H2 | |
| D. | H2(g)+Cl2(g)═2HCl(g);△H1 $\frac{1}{2}$H2(g)+$\frac{1}{2}$ Cl2(g)═HCl(g);△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol金属钠与足量氧气反应转移的电子数为NA | |
| B. | 标准状况下,22.4L甲苯中含C-H键数目为8NA | |
| C. | 标准状况下,11.2L氦气中含有0.5NA个氦原子 | |
| D. | 常温常压下,含有NA个氮气和乙烯分子的混合气体质量为28g |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 序号 | A | B | C | D |
| 物质 | KNO3溶液 | CO2 | 水 | 乙醇 |
| 杂质 | KOH | H2O(g) | 溴 | 水 |
| 除杂试剂 | FeCl3溶液 | - | 乙醇 | 生石灰 |
| 除杂 装置 | 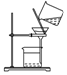 | 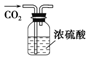 | 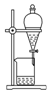 | 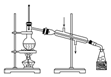 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀醋酸与0.1 mol•L-1NaOH反应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1 | |
| B. | 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热充分反应,放出19.12 kJ热量.则Fe(s)+S(s)═FeS(s)△H=-95.6 kJ•mol-1 | |
| C. | 已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式:2H2O(l)═2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| D. | 已知2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则可知C的燃烧热△H=-110.5 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com