
【题目】碳酸镁晶须是一种新型吸波隐形材料中的增强剂。某工厂以MgCl2(含少量杂质FeCl2、FeCl3)为原料制备碳酸镁晶须(MgCO3·H2O)的工艺流程如下:

已知:Fe3+、Fe2+、Mg2+生成氢氧化物沉淀时的pH
注:Fe(OH)2沉淀呈絮状,不易从溶液中除去。
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mg(OH)2 | 9.9 | 11.0 |
(1)写出“氧化”过程中发生的离子反应方程式_______________。
(2)pH调节的范围___________,滤渣的主要成分___________(填化学式)。
(3)操作X包括过滤、洗涤、烘干,证明碳酸镁晶须已经洗涤干净的方法______________。
(4)水浸后溶液中Fe2+、Fe3+含量的测定
①取水浸后溶液100.00 mL,测得Cl-的浓度为0.455 mol·L-1,向其中缓缓通入氯气使Fe2+恰好完全转化为Fe3+,测得此时溶液中Cl-的浓度为0.460 mol·L-1(溶液体积变化忽略不计)。
②另取水浸后溶液100.00 mL,向其中加入过量的1 mol·L-1NaOH溶液,充分反应后过滤、洗涤、灼烧,冷却后,称得固体粉末的质量为0.96 g。试通过计算确定水浸后溶液中Fe2+、Fe3+的物质的量浓度(写出计算过程)。 _______________________
【答案】![]() 3.7~9.9 Fe(OH)3 取少量最后一次洗涤液,向其中加入硝酸酸化的AgNO3溶液,若无白色沉淀生成则证明已洗涤干净 Fe2+的物质的量浓度为0.005mol/L,Fe3+的物质的量浓度为0.015mol/L
3.7~9.9 Fe(OH)3 取少量最后一次洗涤液,向其中加入硝酸酸化的AgNO3溶液,若无白色沉淀生成则证明已洗涤干净 Fe2+的物质的量浓度为0.005mol/L,Fe3+的物质的量浓度为0.015mol/L
【解析】
原料水浸的溶液中加入过氧化氢,将亚铁离子氧化为铁离子,再调节pH,使铁离子转化为氢氧化铁而除去,过滤后,滤液中氨水与碳酸氢铵得到沉淀,再过滤、洗涤、烘干得到碳酸镁晶须,据此分析解答(1)~(3);
(4)通入氯气发生反应:Cl2+2Fe2+═2Fe3++2Cl-,氯离子浓度的变化量等于溶液中亚铁离子浓度;将加入NaOH溶液得到的沉淀洗涤、灼烧,最终得到Fe2O3,根据Fe原子守恒列式计算n(Fe3+),进而计算溶液中的Fe3+的浓度。
原料水浸加入过氧化氢,将亚铁离子氧化为铁离子,再调节pH,使铁离子转化为氢氧化铁而除去,过滤后,滤液中氨水与碳酸氢铵得到沉淀,再过滤、洗涤、烘干得到碳酸镁晶须.
(1)氧化过程中亚铁离子被过氧化氢氧化生成铁离子,反应的离子方程式为H2O2+2H++2Fe2+═2Fe3++2H2O,故答案为:H2O2+2H++2Fe2+═2Fe3++2H2O;
(2)“调节pH”目的是使Fe3+等杂质离子生成氢氧化铁沉淀除去,且尽量避免Mg2+转化为沉淀,根据各氢氧化物沉淀生成的pH与沉淀完全的pH可知,应控制pH在3.7~9.9之间,滤渣的主要成分为Fe(OH)3,故答案为:3.7~9.9之间;Fe(OH)3;
(3)碳酸镁晶须表面会附着氯离子等,证明碳酸镁晶须已经洗涤干净,只需要检验碳酸镁晶须表面没有氯离子即可,具体操作为:取最后一次洗涤液,加入硝酸酸化,再加入硝酸银溶液,没有白色沉淀生成,说明已洗涤干净,故答案为:取最后一次洗涤液,加入硝酸酸化,再加入硝酸银溶液,没有白色沉淀生成,说明已洗涤干净;
(4)通入氯气发生反应:Cl2+2Fe2+═2Fe3++2Cl-,根据方程式可知,氯离子浓度的变化量等于溶液中亚铁离子浓度,则溶液中c(Fe2+)=△c(Cl-)=0.460mol/L-0.455mol/L=0.005mol/L,将加入NaOH溶液得到的沉淀洗涤、灼烧,最终得到MgO和Fe2O3,设其物质的量分别为xmol和ymol,根据电荷守恒有2x+6y=0.0460mol,根据题意有40x+160y=0.96,解得:x=0.04mol,y=0.001mol,根据Fe原子守恒,n(Fe3+)=0.001mol×2-0.005mol/L×0.1L=0.0015mol,故溶液中的Fe3+的浓度为0.015mol/L,答:水浸后溶液中Fe2+的浓度为0.005mol/L,Fe3+的物质的量浓度为0.015mol/L。


科目:高中化学 来源: 题型:
【题目】已知25℃时:
①HF(aq)+OH-(aq)=F-(aq)+H2O(l) ΔH1=-67.7 kJ·mol-1
②H+(aq)+OH-(aq)=H2O(l) ΔH2=-57.3 kJ·mol-1
③Ba2+(aq)+SO42—(aq)=BaSO4(s) ΔH3<0
下列说法正确的是( )
A.HF的电离方程式及热效应:HF(aq)=H+(aq)+F-(aq) ΔH>0
B.在氢氧化钠溶液与盐酸的反应中,盐酸量一定,氢氧化钠溶液量越多,中和热越大
C.ΔH2=-57.3 kJ·mol-1是强酸和强碱在稀溶液中反应生成可溶盐的中和热
D.稀硫酸与稀氢氧化钡溶液反应的热化学方程式为H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l)ΔH=-114.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各图象的解释或得出的结论正确的是
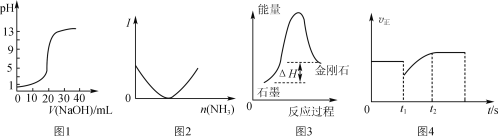
A.图1表示用0.10 mol·L-1 NaOH溶液滴定20.00 mL 0.10 mol·L-1醋酸溶液的滴定曲线
B.图2表示乙酸溶液中通入氨气至过量过程中溶液导电性I的变化
C.根据图3所示可知:石墨比金刚石稳定
D.图4表示反应2SO2+O2![]() 2SO3,t1时刻只减小了SO3的浓度
2SO3,t1时刻只减小了SO3的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿水青山就是金山銀山,生产生活中污染物的合理处理对环境保护具有重要意义。
(1)利用某些催化剂,成功实现将空气中的碳氧化合物和氮氧化合物转化为无毒的大气循环物质。
已知:①![]()
![]()
②NO(g)+CO(g)![]()
![]() N2(g)+CO2(g)
N2(g)+CO2(g)![]()
③2NO(g)+O2(g)![]() 2NO2(g)
2NO2(g) ![]()
反应![]() 的
的![]() ________
________![]() ;某温度下,反应①②③的平衡常数分別カ
;某温度下,反应①②③的平衡常数分別カ![]() 、
、![]() 、
、![]() ,则该反应的K=________(用
,则该反应的K=________(用![]() 、
、![]() 、
、![]() 表示)。
表示)。
(2)温度为![]() ℃吋,在四个容积均为1L的恒容密闭容器中发生反应:
℃吋,在四个容积均为1L的恒容密闭容器中发生反应:
![]()
![]() ,测得有关实验数据如下:
,测得有关实验数据如下:
容器编号 | 物质的起始浓度( | 物质的平衡浓度( | |
|
|
| |
Ⅰ |
|
|
|
Ⅱ |
|
| |
Ⅲ |
|
| |
Ⅳ |
|
| |
①平衡时,容器Ⅱ与Ⅳ容器的总压强之比___________。
②温度不变,容器Ⅲ中达到平衡后再充入NO、![]() (g)各
(g)各![]() mol,则反应将向_____________。(填“正”或“逆”)方向进行。
mol,则反应将向_____________。(填“正”或“逆”)方向进行。
(3)常温下用0.100![]() 盐酸分别滴定10.00mL浓度均为0.100
盐酸分别滴定10.00mL浓度均为0.100![]() 的NaOH溶液和二甲胺[
的NaOH溶液和二甲胺[![]() ]
]
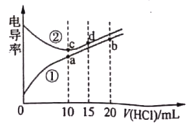
①a、b、c、d四点的水溶液中,由水电离出氢离子浓度大于![]()
![]() 的是________________,原因为_____________________。
的是________________,原因为_____________________。
②化学反应往往伴有热效应若为绝热体系a的温度______________(填“>”,“=”或“<”)c点的温度。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不发生变化。常温下,MFe2Ox能使工业废气中的SO2转化为S,流程如下,则下列判断正确的是( )
![]()
A.MFe2Ox是氧化剂
B.SO2是该反应的催化剂
C.x<y
D.MFe2Oy是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是通过 Li-CO2 电化学技术实现储能系统和 CO2 固定策略的示意团。储能系统使用的电池组成为钌电极/CO2 饱和 LiClO4-(CH3)2SO(二甲基亚砜)电解液/锂片,下列说法不正确的是
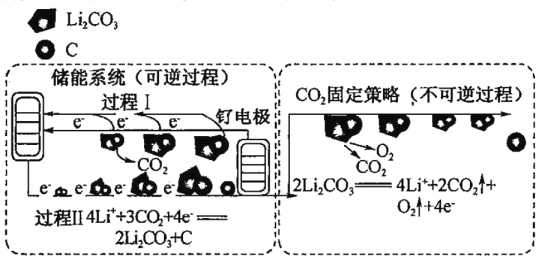
A.Li-CO2 电池电解液为非水溶液
B.CO2 的固定中,转秱 4mole-生成 1mol 气体
C.钌电极上的电极反应式为 2Li2CO3+C - 4e-=4Li++3CO2↑
D.通过储能系统和 CO2 固定策略可将 CO2 转化为固体产物 C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中,甲是电解饱和食盐水,乙是铜的电解精炼,丙是电镀,回答:
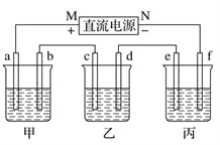
(1)b极上的电极反应式为__,甲电池的总反应化学方程式是__。
(2)在粗铜的电解过程中,图中c电极的材料是__(填“粗铜板”或“纯铜板”);在d电极上发生的电极反应为__;若粗铜中还含有Au、Ag、Fe等杂质,则沉积在电解槽底部(阳极泥)的杂质是__,电解一段时间后,电解液中的金属离子有__。
(3)如果要在铁制品上镀镍(二价金属,相对原子质量59),则f电极的材料是__(填“铁制品”或“镍块”,下同),e电极的材料是__。
(4)若e电极的质量变化118 g,则a电极上产生的气体在标准状况下的体积为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素C的结构简式是 ,维生素C能防治坏血病。
,维生素C能防治坏血病。
(1)维生素C的分子式为_____________。
(2)维生素C中含氧官能团有酯基和_______________(填名称)。
(3)在维生素C溶液中滴入几滴紫色石蕊试液,溶液颜色变红,说明维生素C溶液具有____性。
(4)维生素C具有还原性。向维生素C溶液中滴入几滴酸性KMnO4溶液,现象为_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 浓硝酸和
浓硝酸和![]() 铜反应,铜完全溶解,生成的气体颜色由深变浅
铜反应,铜完全溶解,生成的气体颜色由深变浅![]() 生成
生成![]() 、
、![]() ,共收集到
,共收集到![]() 气体
气体![]() 标准状况
标准状况![]() ,剩余酸用NaOH中和,共耗去
,剩余酸用NaOH中和,共耗去![]() 氢氧化钠
氢氧化钠![]() 。则浓
。则浓![]() 物质的量浓度为
物质的量浓度为![]()
![]()
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com