
| ||
| ||


科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定大于92.2 kJ |
| B、一定小于92.2 kJ |
| C、一定等于92.2 kJ |
| D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 T10C 时,将9molCO2和12molH2充入3L密闭容器中,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,容器中CH3OH的物质的量随时间变化如曲线I所示,平衡时容器内压强为P.改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线II所示.下列说法正确的是
T10C 时,将9molCO2和12molH2充入3L密闭容器中,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,容器中CH3OH的物质的量随时间变化如曲线I所示,平衡时容器内压强为P.改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线II所示.下列说法正确的是| A、曲线II对应的条件改变是减小压强 |
| B、若T2°C时上述反应的平衡常数为0.42,则T2<T1 |
| C、在T10C,若起始时向容器中充入5 mol CO2、5 mol H2、5 mol CH3OH(g)和 5 mol H2O(g),则达平衡前v(正)>v(逆) |
| D、在T10C,若起始时向容器中通入4.5molCO2、6mol H2,平衡时容器内的压强P1=P/2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A>B>E>D |
| B、A>B>D>E |
| C、D>E>A>B |
| D、D>A>B>E |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | a | b | c | d | e | f |
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | NaAlO2 |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
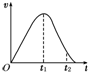 把除去氧化膜的镁条放入盛有一定浓度的稀盐酸的试管中,发现H2的生成速率v随时间t的变化关系如图所示.其中O~t1段速率变化的主要因素是
把除去氧化膜的镁条放入盛有一定浓度的稀盐酸的试管中,发现H2的生成速率v随时间t的变化关系如图所示.其中O~t1段速率变化的主要因素是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com