
分析 (1)第一步电离是完全的,第二步电离是不完全的:HXO4-?H++XO42-,则Na2XO4溶液存在XO42-+H2O?OH-+HXO4-;
(2)已知HXO4-在溶液中部分电离:HXO4-?H++XO42-;
(3)H2XO4溶液存在XO42-,XO42-与钡离子结合生成BaXO4沉淀;
(4)电离常数越大,酸性越强,其盐溶液的水解程度越小;水解程度越大,溶液中酸根离子浓度越小.
解答 解:(1)第一步电离是完全的,第二步电离是不完全的:HXO4-?H++XO42-,则Na2XO4溶液发生水解反应,溶液显弱碱性,其水解离子方程式为:XO42-+H2O?OH-+HXO4-;
故答案为:弱碱性;XO42-+H2O?HXO4-+OH-;
(2)已知HXO4-在溶液中部分电离:HXO4-?H++XO42-,所以0.1mol•L-1的NaHXO4溶液中氢离子浓度小于0.1mol/L;
故答案为:HXO4-在水中的电离是不完全的;
(3)H2XO4溶液存在H2XO4=H++HXO4-,HXO4-?H++XO42-,XO42-与钡离子结合生成BaXO4沉淀,使电离平衡向正方向移动,则发生的离子方程式为:HXO4-+Ba2+=BaXO4↓+H+;
故答案为:HXO4-+Ba2+=BaXO4↓+H+;
(4)酸的电离常数越大,酸性越强,其盐的水解程度越小,HClO电离常数小于H2SO3,所以NaClO的水解程度大,浓度相同时NaClO溶液的pH大于Na2SO3 溶液的pH;水解程度越大,溶液中酸根离子浓度越小,水解程度:CO32->SO32-,则溶液中离子浓度:SO32->CO32->HCO3->HSO3-;
故答案为:大于;SO32->CO32->HCO3->HSO3-.
点评 本题考查了盐类水解、弱电解质的电离等知识点,根据弱电解质电离特点、盐类水解特点来分析解答即可,注意把握电离常数与酸性强弱的关系,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 反应A(g)?2B(g)△H,若正反应的活化能为Ea kJ•mol-1,逆反应的活化能为Eb kJ•mol-1,则△H=-(Ea-Eb)kJ•mol-1 | |
| B. | 某温度下,氯化钠在水中的溶解度是20g,则该温度下的饱和氯化钠溶液溶质的质量分数为20% | |
| C. | 将浓度为0.1 mol•L-1HF溶液加水不断稀释过程中,电离平衡常数Ka(HF)保持不变,$\frac{{c({F^-})}}{{c({H^+})}}$始终保持增大 | |
| D. | 将0.2 mol•L-1的CH3COOH溶液与0.1 mol•L-1的NaOH溶液等体积混合后,溶液中有关粒子的浓度满足下列关系:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:Q>W>Z | |
| B. | Q的氢化物的水溶液一定具有强酸性 | |
| C. | X、Y、Q可同时存在同一离子化合物中 | |
| D. | 单质的沸点:W>Q>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①⑤⑥ | B. | ②④⑦ | C. | ①⑥⑦ | D. | ⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
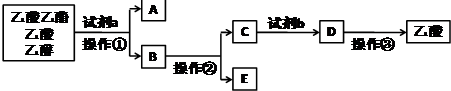
| A. | 操作①用到的玻璃仪器主要有分液漏斗、烧杯 | |
| B. | 工业制备无水E物质的方法是在E中加生石灰后进行操作② | |
| C. | 试剂b可用硫酸 | |
| D. | 操作③用到的仪器和用品主要有漏斗、烧杯、玻璃棒、滤纸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硝基还原为氨基:
硝基还原为氨基: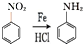
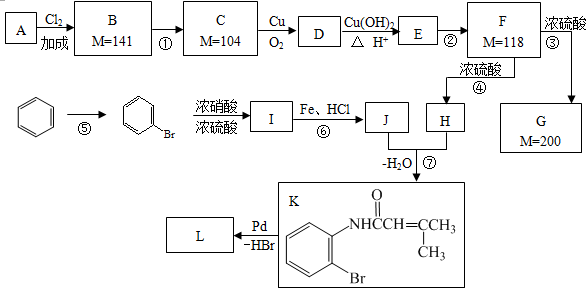
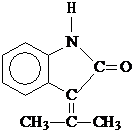 .
.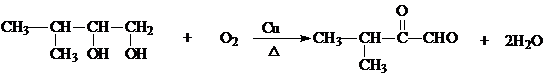 .
. .
.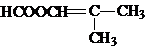 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、K+、SO42- | B. | Cu2+、SO42-、NO3- | C. | Na+、K+、Cl- | D. | MnO4-、K+、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com