
| A. | 如果a1=a2,b1=b2,则混合溶液中c(CH3COO-)=c(Na+) | |
| B. | 如果混合溶液的PH=7,则混合溶液中c(CH3COO-)>c(Na+) | |
| C. | 如果混合溶液的PH<7,则a1b1=a2b2 | |
| D. | 如果a1=a2,且混合溶液的PH<7,则b1>b2 |
分析 A.如果a1=a2,b1=b2,则a1b1=a2b2,醋酸与氢氧化钠的物质的量相等,反应生成醋酸钠溶液,醋酸根离子水解,导致醋酸根离子浓度减小;
B.混合液的pH=7,溶液显示中性,则c(OH-)=c(H+),根据电荷守恒判断;
C.如果混合溶液的pH<7,则醋酸过量,即a1b1>a2b2;
D.当a1=a2,b1=b2时,恰好反应生成醋酸钠,溶液也显示碱性,若a1=a2、pH<7,则b1>b2.
解答 解:A.如果a1=a2,b1=b2,则a1b1=a2b2,两溶液恰好反应生成醋酸钠,由于醋酸根离子的水解,导致溶液中c(CH3COO-)减小,则c(CH3COO-)<c(Na+),故A错误;
B.如果混合液的pH=7,则c(OH-)=c(H+),根据电荷守恒c(OH-)+c(CH3COO-)=c(H+)+c(Na+)可得:c(CH3COO-)=c(Na+),故B错误;
C.a1=a2,b1=b2,则a1b1=a2b2,醋酸与氢氧化钠恰好反应生成醋酸钠,溶液显示碱性,则溶液的pH>7,故C错误;
D.当a1=a2,如果b1=b2,反应后生成醋酸钠,溶液呈碱性,若混合溶液的pH<7时,则一定满足b1>b2,故D正确;
故选D.
点评 本题考查了酸碱混合的定性判断、离子浓度定性比较,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系,明确判断溶液中离子浓度大小的方法,能够根据电荷守恒、物料守恒、盐的水解原理等知识判断离子浓度大小.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 将灼烧变黑的热铜丝插入装少量无水乙醇的试管中 | 铜丝变红 | 乙醇具有氧化性 |
| B | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3•H2O能大量共存 |
| C | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置 | 下层溶液显紫红色 | 氧化性:Fe3+>I2 |
| D | 用硫酸做催化剂的淀粉水解液中,加入新制Cu(OH)2悬浊液,加热 | 无砖红色沉淀生成 | 淀粉未发生水解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内消耗1mol的H2O同时生成1mol的H2 | |
| B. | 两个H-O键断裂的同时有四个C-O键断裂 | |
| C. | 反应容器内的密度不再发生变化 | |
| D. | 混合气体的相对分子质量不发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
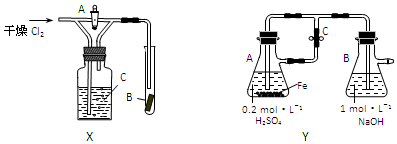
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | a | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上常通过电解熔融的MgO冶炼金属镁 | |
| B. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 | |
| C. | 用惰性电极电解Na2SO4溶液,阴、阳两极产物的物质的量之比为1:2 | |
| D. | 已知:①2H2(g)+O2(g)=2H2O(g)△H=-aKJ/mol ②2H2(g)+O2(g)═2H2O(l)△H=-bKJ/mol△H1<△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | ①和③ | C. | ①②③⑤ | D. | ①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
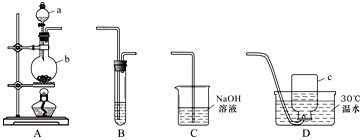
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com