
工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下(金属单质E可由滤液C制取):
已知:Cu2O + 2H+ =" Cu" + Cu2+ + H2O。
(1)滤液A中铁元素的可能存在形式为_______(填离子符号),与之相关的离子方程式为_____________,若滤液A中存在Fe3+,检验该离子的试剂为________(填试剂名称)。
(2)写出E和F反应生成铜的化学方程式为_____________________________。
(3)利用电解法进行粗铜精炼时,下列叙述正确的是_________(填代号)。
a.若用硫酸铜溶液作电解液,SO2- 4向阴极移动
b.粗铜接电源正极,发生还原反应
c.精铜作阴极,电解后电解液中Cu2+浓度减小
d.当粗铜消耗6.4 g时,转移0.2NA个电子
科目:高中化学 来源: 题型:填空题
我国有丰富的天然气资源。以天然气为原料合成尿素的主要步骤如下图所示(图中某些转化步骤及生成物未列出):
填写下列空白:
(1)已知0.5 mol甲烷和0.5 mol水蒸气在t ℃,p k Pa时,完全反应生成一氧化碳和氢气(合成气),吸收了a kJ热量,该反应的热化学方程式是 。
(2)上述流程中,工业上分离H2 、CO2合理的方法是 。
A混合气先通入氢氧化钠溶液,再在溶液中加盐酸
B混合气加压冷却,使CO2液化
C混合气用氨水洗涤
D混合气先通入到石灰浆,然后高温煅烧固体,
(3)为了保证氨气顺利合成,在空气进入合成塔之前必须对空气进行 ,目的是____________________;在合成氨的实际生产过程中,常采取将生成的氨从混合气体中分离出来,分离出氨的方法 。
(4)合理地利用资源不仅可以提高经济效益,而且也是对社会、对全人类负责的表现,阐述图中的两处可以合理利用资源情况 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
随着世界粮食需求量的增加,农业对化学肥料的需求越来越大。氮肥是需求最大的一种化肥。氮肥的生产和合理施用在农业生产中起着重大作用。合成氨及化肥生产流程示意图如下:
(1)目前,工业上用铁触媒作催化剂,在20~50 MPa、450℃左右用氮、氢混合气体在________中进行合成氨。则沿X方向回去的物质是________。
(2)目前生产尿素是以氨气与CO2为原料,发生反应的化学方程式是________、________。
尿素适用于各种土壤,在土壤中尿素发生水解,其水解的化学方程式是________。
(3)沉淀池中发生反应的化学方程式是________________。
(4)上述生产中的副产品氯化铵长期使用会造成土壤酸化、变硬甚至板结。对土壤的酸碱性进行测定与改良是保护________、提高土壤肥力的有效途径。测定土壤的pH的方法是________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
石膏也可用于工业生产二氧化硫,进而生产硫酸。天然石膏的化学式为CaSO4·2H2O。将天然石膏脱水后,第2步化学反应就可制得二氧化硫。
(1)写出第1步反应的化学方程式__________________________________。
(2)在第2步化学反应中,下列原料可以使用的是(用序号填空)__________。写出有关化学反应的方程式_______________________________
①空气 ②氧气 ③硫酸 ④焦炭
(3)在第2步化学反应中,可能会排入空气的气态污染物是________。它(或它们)的主要危害是______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:
(1)溴在周期表中位于________周期__________族。
(2)步骤①中用硫酸酸化可提高Cl2的利用率,理由是___________________________。
(3)步骤④利用了SO2的还原性,反应的离子方程式为__________________________。
(4)步骤⑥的蒸馏过程中,温度应控制在80~90℃温度过高或过低都不利于生产,请解释原因____________________________________________________。
(5)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。分离仪器的名称是______________________________________。
(6)步骤①、②之后并未直接用“含Br2的海水”进行蒸馏得到液溴,而是经过“空气吹出”、“SO2吸收”、“氧化”后再蒸馏,这样操作的意义是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(12分)【化学——化学与技术】合成氨工业、硝酸工业、硫酸工业是化学工业的重要组成部分。请回答下列问题:
(1)右图是工业制硫酸的流程示意图: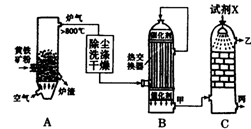
①设备A的名称为 。
②试剂X为 。
③B设备中热交换器的作用是 。
(2)工业制硝酸时,酸吸收塔中的水吸收NO2是放热反应,为使NO2更好被吸收,可采取措施是 ;工业上用Na2 CO3溶液吸收NO2的化学方程式为 。
(3)工业合成氨的化学方程式为 ,选择天然气做为合成氨原料气的优点是 。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NaIO3是氧化剂,HSO3-是还原剂 |
| B.生产中可得到副产物H2SO4和Na2SO4 |
| C.I2既是氧化产物又是还原产物 |
| D.HSO3-的还原性比I-弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于工业生产的叙述中错误的是( )。
| A.制普通玻璃的主要原料是纯碱、石灰石、石英砂 |
| B.工业上电解熔融的氯化钠来制取钠 |
| C.将二氧化硫催化成三氧化硫后,在吸收塔内用水吸收制得浓硫酸 |
| D.制造普通水泥的主要原料是黏土、石灰石 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
工业上合成氨的原料之一为氢气,其来源之一是利用石油气的有关成分如丙烷(C3H8)制取。以下途径,假设反应都能进行,从经济效益考虑最合理的反应是( )。
A.C3H8 3C+4H2 3C+4H2 |
B.C3H8 C3H6+H2 C3H6+H2 |
C.C3H8+6H2O 3CO2+10H2 3CO2+10H2 |
D.2H2O 2H2↑+O2↑ 2H2↑+O2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com