
【题目】[选修3—物质结构与性质]
(1)Ⅰ、下列物质的结构或性质与氢键无关的是( )
A.乙醚的沸点
B.乙醇在水中的溶解度
C.氢化镁的晶格能
D.DNA的双螺旋结构
(2)Ⅱ、钒(23V)是我国的丰产元素,广泛用于催化及钢铁工业。
回答下列问题:
(1)钒在元素周期表中的位置为 ,其价层电子排布图为 。
(2) 钒的某种氧化物的晶胞结构如图1所示。晶胞中实际拥有的阴、阳离子个数分别为 。
(3)V2O5常用作SO2转化为SO3的催化剂。SO2分子中S原子价层电子对数是 对,分子的立体构型为 ;SO3气态为单分子,该分子中S原子的杂化轨道类型为 ;SO3的三聚体环状结构如图2所示,该结构中S原子的杂化轨道类型为 ;该结构中S—O键长由两类,一类键长约140pm,另一类键长约为160pm,较短的键为 (填图2中字母),该分子中含有 个σ键。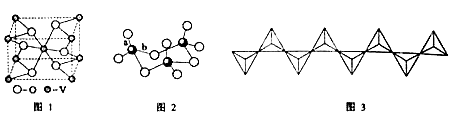
(4) V2O5溶解在NaOH溶液中,可得到钒酸钠(Na2VO4),该盐阴离子的立体构型为 ;也可以得到偏钒酸钠,其阴离子呈如图3所示的无限链状结构,则偏钒酸钠的化学式为 。
【答案】
(1)A,C
(2)第4周期ⅤB族;![]() ;4;2;3;V形;sp2杂化;sp3杂化;a;12;正四面体形;NaVO3
;4;2;3;V形;sp2杂化;sp3杂化;a;12;正四面体形;NaVO3
【解析】
I、A、乙醚分子间不存在氢键,乙醚的沸点与氢键无关,正确;B,乙醇和水分子间能形成氢键,乙醇在水中的溶解度与氢键有关,错误;C,氢化镁为离子化合物,氢化镁白晶格能与氢键无关,正确;D,DNA的双螺旋结构涉及碱基配对,与氢键有关,错误,选AC。
II、(1)钒在元素周期表中的位置为第4周期第VB族,其价层电子排布式为![]() ,
,![]() 。
。
(2)分析钒的某种氧化物的晶胞结构利用切割法计算,晶胞中实际拥有的阴离子氧离子数目为4x1/2+2=4,阳离子钒离子个数为8x1/8+1=2。
(3)![]() 分子中S原子价电子排布式为
分子中S原子价电子排布式为![]() , 价层电子对数是3对,分子的立体构型V形;根据杂化轨道理论判断气态
, 价层电子对数是3对,分子的立体构型V形;根据杂化轨道理论判断气态![]() 单分子中S原子的杂化轨道类型为
单分子中S原子的杂化轨道类型为![]() 杂化;由
杂化;由![]() 的三聚体环状结构判断,该结构中S原子形成4个键,硫原子的杂化轨道类型为
的三聚体环状结构判断,该结构中S原子形成4个键,硫原子的杂化轨道类型为![]() 杂化;该结构中S-O键长两类,一类如图中a所示,含有双键的成分键能较大,键长较短,另一类为配位键,为单键,键能较小,键长较长;由题给结构分析该分子中含有12个
杂化;该结构中S-O键长两类,一类如图中a所示,含有双键的成分键能较大,键长较短,另一类为配位键,为单键,键能较小,键长较长;由题给结构分析该分子中含有12个![]() 键。
键。
(4)根据价层电子对互斥理论类断苷酸钠(![]() )中阴离子的立体构型为正四面体形;也可以得到偏钒酸钠,其阴离子呈如图3所示的无限链状结构,则偏钒酸钠的化学式
)中阴离子的立体构型为正四面体形;也可以得到偏钒酸钠,其阴离子呈如图3所示的无限链状结构,则偏钒酸钠的化学式![]() 。
。


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】二硫化碳(CS2,标况下为液体)能够在氧气中完全燃烧生成CO2和SO2,今用0.228g CS2在448mL O2(在标准状况下)中完全燃烧,反应后气体混合物在标准状况下的体积是( )
A. 112mL B. 224mL C. 336mL D. 448mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外实验小组设计的下列实验不合理的是( )
A. 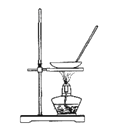 蒸干NH4Cl饱和溶液制备NH4Cl晶体
蒸干NH4Cl饱和溶液制备NH4Cl晶体
B. 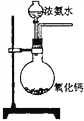 实验室制备少量氨气
实验室制备少量氨气
C. 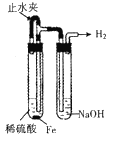 制备并观察氢氧化亚铁
制备并观察氢氧化亚铁
D. 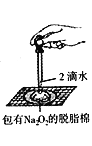 证明过氧化钠与水反应放热
证明过氧化钠与水反应放热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)Si(g)+4HCl(g);△H=+Q kJmol﹣1(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达平衡时,吸收热量为Q kJ
C.反应至4min时,若HCl浓度为0.24 mol/L,则H2的反应速率为0.03 mol/(Lmin)
D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100mL 1molL﹣1的NaOH溶液恰好反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意填空
(1)写出H2C2O4与KMnO4酸性溶液反应的化学方程式.
(2)若要测定此反应的化学反应速率,最方便的测定方法是测定;
基于此,在实验时H2C2O4与KMnO4初始物质的量需要满足的关系为n(H2C2O4):n (KMnO4)≥ .
(3)为研究温度、浓度对此反应速率的影响,请完成以下表格
编号 | 0.1mol/L H2C2O4 溶液的体积/mL | 0.01mol/L 酸性 KMnO4 的体积/mL | 蒸馏水的体积/mL | 温度/℃ |
① | 2 | 4 | 2 | 25 |
② | 3 | |||
③ | 50 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学中有很多物质可以实现下图中物质之间的转化。其中反应条件和部分反应的产物已略去。液体B和C可能是单一溶质的溶液,也可能是纯净物。

(1)若A是一种红色金属,气体D能使品红溶液褪色,加热时又恢复原色。写出反应①的化学方程式_______________________________________________。
(2)若A是金属单质,D是一种无色气体,遇到空气变为红棕色,液体C呈浅绿色。
写出反应①的离子方程式________________________________________; 写出反应②的任意一个离子方程式____________________________________________。
(3)若A是一种金属单质,D是最轻的气体,B能否是NaOH溶液________(填“能”或“否”),若能,写出相应的离子方程式 (若否,则不用填此空)__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,向500—600℃的铁屑中通入氯气生产无水氯化铁;向炽热铁屑中通入氯化氢生产无水氯化亚铁。现用如图所示的装置模拟上述过程进行试验。回答下列问题: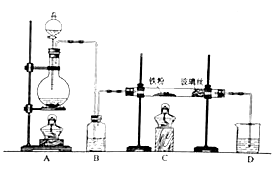
(1)制取无水氯化铁的实验中,A中反应的化学方程式为 , 装置B中加入的试剂是 。
(2)制取无水氯化亚铁的实验中,装置A用来制取。尾气的成分是 。若仍用D的装置进行尾气处理,存在的问题是。
(3)若操作不当,制得的FeCl2 , 会含有少量 FeCl3 , 检验FeCl2常用的试剂是 。欲制得纯净的FeCl2 , 在实验操作中应先 , 再 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期主族元素W,X,Y,Z的原子序数依次增大,W,X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性.下列说法正确的是( )
A.简单离子半径:W<X<Z
B.W与X形成的化合物溶于水后溶液呈碱性
C.气态氢化物的热稳定性:W<Y
D.最高价氧化物的水化物的酸性:Y>Z
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com