
【题目】乙二酸俗称草酸,其钠盐和钾盐易溶于水,钙盐难溶于水。草酸晶体(H2C2O4·2H2O)无色、熔点为101℃。易溶于水,150℃-160℃大量升华,170℃以上分解。回答下列问题:
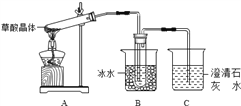
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物,装置C中可观察到的现象是__________________________,由此可知草酸晶体分解的产物中有______________,装置B的主要作用是_____________________________________。
(2)乙组同学认为草酸晶体分解的产物中含有H2O和CO,为进行验证,选用下图中的装置进行实验。
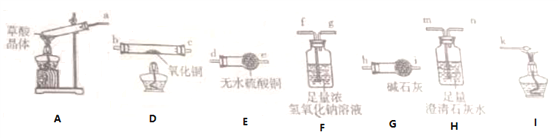
实验装置连接的合理顺序为a→___________________→k(填小写字母),能证明草酸晶体分解产物中有CO的现象是______________________________________________________________,草酸晶体受热分解的化学方程式为_______________________________________________________________。
(3)用酸性KMnO4溶液滴定反应结束后的F溶液,测定Na2C2O4的浓度
实验步骤:取20.00mLF中的溶液于锥形瓶中,再向锥形瓶中加入足量稀H2SO4,用0.1600mol/L酸性高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶被25.00mL。
①高锰酸钾溶液应装在_________(填“酸式”或“碱式”)滴定管中。
②滴定终点的现象是_______________________________________________________。
③计算F溶液中Na2C2O4的物质的量浓度为_________。
【答案】 澄清石灰水出现白色浑浊 CO2 冷凝草酸,防止草酸进入C中与澄清石灰水作用生成沉淀干扰CO2的检验 →d→e→f→g→h→i→b→c→m→n D中固体由黑变红,H中出现白色浑浊 H2C2O4·2H2O![]() CO↑+CO2↑+3H2O 酸式 滴入最后一滴高锰酸钾溶液后,溶液颜色由无色变为红色,且30秒内不褪色 0.5000mol/L
CO↑+CO2↑+3H2O 酸式 滴入最后一滴高锰酸钾溶液后,溶液颜色由无色变为红色,且30秒内不褪色 0.5000mol/L
【解析】(1)草酸晶体(H2C2O42H2O)中碳元素为+3价,如果受热分解,推测可能发生歧化反应,C元素化合价升高,生成CO2;若装置C中有气泡冒出且澄清石灰水变浑浊,则证明有CO2生成。草酸易挥发,导致生成的气体中含有草酸,草酸和氢氧化钙反应生成难溶性的草酸钙而干扰CO2的检验,所以B装置冰水冷凝草酸,防止干扰二氧化碳的检验。
故答案为:澄清石灰水出现白色浑浊;CO2;冷凝草酸,防止草酸进入C中与澄清石灰水作用生成沉淀干扰CO2的检验;
(2)要检验产物中是否有H2O(g),可将气体先通入无水硫酸铜,若无水硫酸铜变蓝,则证明有水产生。要检验生成CO,可将气体通过灼热的氧化铜,若黑色氧化铜变红,且产生能使澄清石灰水变浑浊的气体,则说明生成了CO。为避免草酸分解产生的CO2的干扰,所以先用浓NaOH除去草酸分解的CO2,用碱石灰干燥后,再将气体通入灼热的CuO,利用澄清石灰水检验是否产生了CO2;CO为有毒气体,所以要用排水法收集CO避免环境污染,所以其连接顺序是d→e→f→g→h→i→b→c→m→n,注意气体进入溶液时,应是长进短出,即f→g,m→n。草酸分解产生水、CO、CO2,则反应方程式为H2C2O4·2H2O![]() CO↑+CO2↑+3H2O。
CO↑+CO2↑+3H2O。
故答案为:d→e→f→g→h→i→b→c→m→n;D中固体由黑变红,H中出现白色浑浊;H2C2O4·2H2O![]() CO↑+CO2↑+3H2O;
CO↑+CO2↑+3H2O;
(3)①高锰酸钾溶液有强氧化性,会腐蚀橡胶,所以酸性高锰酸钾应装置酸式滴定管中。
②Na2C2O4酸化后,生成H2C2O4,草酸反应完毕,加入最后一滴KMnO4溶液,溶液变为红色,红色30s内不褪去,说明滴定到终点;
③令Na2C2O4的物质的量浓度为c,由2KMnO4~5H2C2O4~5Na2C2O4,可知:20mL×c=![]() ×25mL×0.16mol/L,解得c=0.5000 mol/L;所以F溶液中Na2C2O4的物质的量浓度为0.5000 mol/L。
×25mL×0.16mol/L,解得c=0.5000 mol/L;所以F溶液中Na2C2O4的物质的量浓度为0.5000 mol/L。


 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
【题目】向恒温、恒容(2L)的密闭容器中充入2 mol SO2和一定量的O2,发生反应:2SO2(g) + O2(g)![]() 2SO3(g) ; △H= -197.74 kJ·mol-1,4min后达到平衡,这时c(SO2)=0.2mol·L-1,且SO2和O2的转化率相等。下列说法中,不正确的是
2SO3(g) ; △H= -197.74 kJ·mol-1,4min后达到平衡,这时c(SO2)=0.2mol·L-1,且SO2和O2的转化率相等。下列说法中,不正确的是
A.2min时,c(SO2)=0.6mol·L-1
B.用O2表示4min内的反应速率为0.1mol·(L·min)-1
C.再向容器中充入1mol SO3,达到新平衡,n(SO2):n(O2)=2:1
D.4min后,若升高温度,平衡向逆方向移动,平衡常数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把6molA气体和5molB气体混合放入4L密闭容器中,在一定条件下发生反应:3A (g)+B(g)2C(g)+xD(g),经5min达到平衡,此时生成C为2mol,测定D的平均反应速率为0.1mol/(Lmin),下列说法错误的是( )
A.x=2
B.B的转化率为20%
C.平衡时A的浓度为0.75mol/L
D.恒温达平衡时容器内的压强为开始时的85%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明N2O与CO在Fe+作用下发生反应的能量变化及反应历程如图所示,下列说法错误的是
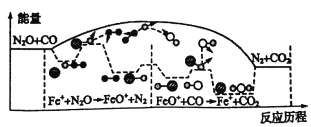
A. 反应总过程△H<0
B. Fe+使反应的活化能减小
C. 总反应若在2L的密闭容器中进行,温度越高反应速率一定越快
D. Fe++N2O→FeO++N2、FeO++CO→Fe++CO2两步反应均为放热及应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和氮是地球上含量丰富的两种元素。其氧化物的化学热力学、动力学研究有助于人类充分利用化石燃料,消除氧化物对环境的负面影响。
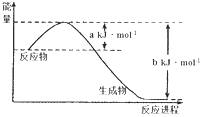
(1)下图是25℃,101kPa时,1molNO2气体和1molCO反应生成CO2和NO过程中能量变化示意图。写出该反应的热化学方程式____________________________________。
(2)在不同温度下,向2L密闭容器中加入1molNO和1mol活性炭,发生反应:2NO(g)+C(s)![]() N2(g)+CO2(g),达到平衡时的数据如下:
N2(g)+CO2(g),达到平衡时的数据如下:
温度 | n(C)/mol | n(CO2)/mol |
T1 | 0.3 | |
T2 | 0.6 |
请回答下列问题:
①T1℃时,该反应的平衡常数K=___________。
②T2℃时,下列能判断该反应达到平衡状态的是___________(填序号)。
A.v(CO2)正=2v(NO)逆 B.混合气体的平均相对分子质量不再变化
C.混合气体的密度不再变化 D.N2、CO2的物质的量之比不再变化
③T2℃时,若达平衡后再充入0.4molNO和0.3molCO2,平衡向___________(填“正向”“逆向“或“不”)移动。
④若△H<O,则T1___________T2(填“>”或“<”)。
(3)电解法处理含氮氧化物废气,可回收硝酸。实验室模拟电解法吸收NOx的装置如右图所示:

①若用NO2气体进行模拟电解法吸收实验,写出NO2发生反应的电极反应式________________。
②若有标况下2.24LNO被吸收,通过阳离子交换膜的H+为___________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X元素的阳离子与Y的阴离子具有相同的核外电子排布,则下列比较中正确的是( )
A.原子序数: X<YB.原子半径:X<Y
C.离子半径:X<Y D.原子最外层电子数:X<Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)紫薯营养丰富,具有特殊的保健功能。下表是100 g紫薯粉的营养成分含量表:
营养成分 | 含量(每100 g) | 营养成分 | 含量(每100 g) |
水分 | 9.9 g | 钙元素 | 23.00 mg |
脂肪 | 0.2 g | 铁元素 | 1.10 mg |
蛋白质 | 4.8 g | 硒元素 | 0.02 mg |
淀粉 | 82.5 g | 花青素 | 0.10 g |
纤维素 | 2.7 g | 其他 | …… |
①以上营养成分中,______是人体中含有的微量元素。
②紫薯粉中的脂肪在人体内会水解成高级脂肪酸和______。
③蛋白质在人体内水解的最终产物是氨基酸,其结构可表示为R—CH(NH2)—X,则“—X”的名称为___。
④在酶的作用下,淀粉水解为葡萄糖,葡萄糖再转化为乙醇和二氧化碳。写出葡萄糖转化为乙醇的化学方程式______。
(2)合理饮食、正确使用药物对人体健康至关重要。
①“中国居民平衡膳食宝塔”如图所示,位于最上层且每天不超过25g的能量物质是______。
②某品牌饼干的配料标签如图所示,其中苯甲酸钠的作用是______。

③三硅酸镁(Mg2Si3O8·nH2O)具有治疗胃酸过多的作用,写出其与胃酸反应生成SiO2·H2O等物质的化学方程式______。
(3)材料的生产与使用是人类文明和生活进步的一个重要标志。
①我国C919大型客机的机身蒙皮使用的是第三代铝锂合金材料,选用铝锂合金的优点是______(任答一点)。
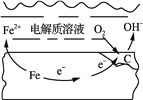
②铁路建设中如何防止铁轨的腐蚀是工程技术人员攻克的难题之一。钢铁在潮湿的空气中易发生吸氧腐蚀如图所示,则正极的电极反应式为______。
③玻璃中加入适量的溴化银(AgBr)和氧化铜的微小晶粒,经过适当的热处理,可以制成变色玻璃,请写出强光照射变色玻璃时发生反应的化学方程式______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com