
| A. | 用3体积的乙醇与l体积的浓H2SO4混合加热到170℃制乙烯 | |
| B. | 加入适量浓溴水除去苯中混有的少量苯酚 | |
| C. | 用饱和食盐水和电石(CaC2)在启普发生器中制乙炔 | |
| D. | 以硫酸、碳酸钠、苯酚钠溶液为试剂,验证酸性强弱关系:硫酸>碳酸>石炭酸 |
分析 A.制乙烯用1体积的乙醇与3体积的浓H2SO4混合加热到170℃;
B.除杂时不能引入新杂质;
C.实验室中常用电石跟水反应制取乙炔,与水的反应是相当激烈的,可用分液漏斗控制加水量以调节出气速度,也可以用饱和食盐水;
D.强酸可以制取弱酸,可以根据反应来判断酸性强弱.
解答 解:A.用1体积的乙醇与3体积的浓H2SO4混合加热到170℃制乙烯,故A错误;
B.苯酚与溴水反应生成的三溴苯酚易溶于苯,引入新杂质,故B错误;
C.不能用启普发生器呢是因为一方面电石吸水性太强,若用启普发生器控制不住电石和水的反应;另一方面该反应非常激烈,放热太多,若用启普发生器则有爆炸的危险,故C错误;
D.根据强酸可以制取弱酸来判断,故D正确;
故选D.
点评 本题考查了常见有机化合物的制备方法,注意乙烯、乙炔的实验室制备方法和注意事项,物质的除杂及酸性强弱判断,题目难度不大.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:选择题
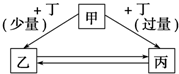 甲、乙、丙、丁均为中学化学中常见的物质,它们之间存在如图所示的转化关系(部分产物略去),甲不可能是( )
甲、乙、丙、丁均为中学化学中常见的物质,它们之间存在如图所示的转化关系(部分产物略去),甲不可能是( )| A. | NaOH溶液 | B. | Fe | C. | Al2O3 | D. | C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是常见原电池装置,电流表G发生偏转:
如图是常见原电池装置,电流表G发生偏转:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
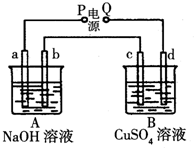 按如图装置实验,A、B两烧杯分别盛放200g 10%NaOH和足量CuSO4溶液.通电一段时间后,c极上有Cu析出;又测得A杯中溶液的质量减少4.5g(不考虑水的蒸发).a、b、c为石墨电极,d为铜电极.
按如图装置实验,A、B两烧杯分别盛放200g 10%NaOH和足量CuSO4溶液.通电一段时间后,c极上有Cu析出;又测得A杯中溶液的质量减少4.5g(不考虑水的蒸发).a、b、c为石墨电极,d为铜电极.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 各物质的浓度之比为1:3:3 | |
| B. | 混合物各物质的浓度相等 | |
| C. | ν(A)、ν(B)、ν(C) 之比为1:3:3 | |
| D. | A、B、C三种物质的浓度不随时间变化而变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属晶体能导电,所以离子晶体也能导电 | |
| B. | 六方最密堆积和面心立方最密堆积中由于配位数都是12,所以所得晶胞的形式相同 | |
| C. | 金属晶体中金属原子的堆积模式有4种 | |
| D. | 金属晶体的电子气理论不能解释金属的延展性,但可以解释金属的导电性和熔点高低 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1 mol SO2的总能量大于1 mol S和1 mol O2能量总和 | |
| B. | 1 mol SO2的总能量小于1 mol S和1 mol O2能量总和 | |
| C. | S(s)+O2(g)=SO2(g)△H=-b kJ•mol-1,b小于a | |
| D. | S(s)+O2(g)=SO2(g)△H=-b kJ•mol-1,b大于a |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com