
【题目】W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子的核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物。
(1)W位于元素周期表第_____周期第____族。W的气态氢化物稳定性比H2O(g)_______(填“强”或“弱”)。
(2)Y的基态原子的核外电子排布式是______, Y的第一电离能比X的________(填“大”或“小”)。
(3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是_________。
【答案】二 ⅤA 弱 1s22s22p63s23p4 大 Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
【解析】
W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,包括氮氧化物和硫氧化物,则W为N元素,Y为S元素;X的基态原子核外有7个原子轨道填充了电子,s有1个原子轨道,p有3个原子轨道,则电子排布式为1s22s22p63s23p1,X为Al元素;Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物,则Z为Cu元素,据此分析解答。
根据上述分析,W为N元素,X为Al元素,Y为S元素,Z为Cu元素。
(1)W为N元素,位于第二周期VA族,非金属性O大于N,则W的气态氢化物稳定性比H2O(g)弱,故答案为:二;VA;弱;
(2)Y为S元素,Y的基态原子核外电子排布式是1s22s22p63s23p4;同一周期中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第ⅡA族、第VA族元素第一电离能大于相邻元素,则S的第一电离能比Al大,故答案为:1s22s22p63s23p4;大;
(3)S的最高价氧化物对应水化物为硫酸,浓硫酸与铜反应的化学方程式是Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,故答案为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在3个体积均为1.0L的恒容密闭容器中发生反应2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0。达到平衡时,下列说法正确的是
2SO3(g) ΔH<0。达到平衡时,下列说法正确的是
容器 | 温度/℃ | 物质的起始浓度/mol·L-1 | 物质的平衡浓度/mol·L-1 | ||
c(SO2) | c(O2) | c(SO3) | c(SO3) | ||
Ⅰ | 758 | 0.2 | 0.1 | 0 | 0.044 |
Ⅱ | 758 | 0.1 | 0.05 | 0 | |
Ⅲ | 858 | 0.2 | 0.1 | 0 | |
A. 从开始至平衡时,容器Ⅰ中SO3的反应速率为0.044 mol·L-1·s-1
B. 平衡时,容器Ⅱ中SO3的浓度小于0.022mol·L-1
C. 平衡时,容器Ⅲ中SO3的浓度大于0.044mol·L-1
D. 若起始时,向容器Ⅰ中充入0.02mol SO2、0.01mol O2和0.02mol SO3,则反应向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】课外小组用如图所示装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
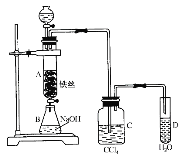
(1)写出A中反应的化学方程式:________________________,反应类型为____________。
(2)观察A中的现象是:___________________________________________________。
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是_______,写出有关化学方程式___________。
(4)C中盛放CCl4的作用是______________________________________。
(5)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证方法是向试管D中加入________,现象是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素包括F、Cl、Br等元素。
(1)下列曲线表示卤族元素某种性质随核电荷数的变化趋势,正确的是_______。
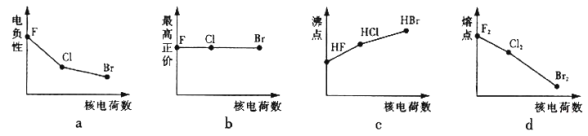
(2)在测定HF的相对分子质量时,实验测定值一般高于理论值的主要原因是______________。
(3)BCl3和NCl3中心原子的杂化方式是否相同_____________(填 是 或 否)。第一电离能介于B、N之间的第二周期元素有_______种。
(4)铑(Rh)与碘属于同周期元素。铑的某配合物的化学式为CsRh(SO4)2,该物质易溶于水,向其水溶液中加入一定浓度的BaCl2溶液,无沉淀生成,该盐溶于水的电离方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种蓝色晶体[可表示为MxFey(CN)6],经X射线研究发现,它的结构特征是Fe3+和Fe2+互相占据立方体互不相邻的顶点,而CN-位于立方体的棱上。其晶体中阴离子的最小结构单元如下图所示。下列说法正确的是( )。
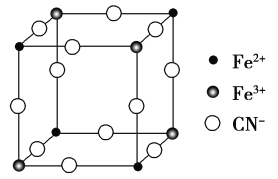
A. 该晶体属于离子晶体,M呈+1价
B. 该晶体属于离子晶体,M呈+2价
C. 该晶体属于分子晶体,化学式为MFe2(CN)6
D. 晶体中与每个Fe3+距离最近且等距离的CN-有12个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z三种元素,已知:①X、Y、Z的单质在常温下均为气体;②X单质可在Z单质中燃烧,生成XZ,火焰为苍白色;③XZ极易溶于水,其水溶液可使蓝色石蕊试纸变红;④每2个X2分子可与1个Y2分子化合生成2个X2Y分子,X2Y在常温下为液体;⑤Z单质溶于X2Y中,所得溶液具有漂白作用;⑥细铁丝能在Z2(g)中剧烈燃烧,且产生红棕色烟。推断:
(1)X、Y两种元素的名称X___,Y___。
(2)化合物的化学式:XZ___,X2Y___。
(3)过程⑥中涉及的化学反应方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学应用如下所示装置研究物质的性质。其中气体X的主要成分是氯气,还含有少量空气和水蒸气。请回答下列问题:
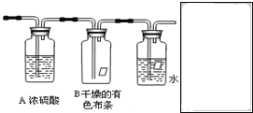
(1)B中观察到的实验现象是___。
(2)从物质性质方面来看,这样的实验设计还存在事故隐患,应如何处理,请画出装置图(填在图方框内),用化学方程式表达原理___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是( )
A. 标准状况下,22.4L H2O含有的分子数为1 NA
B. 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA
C. 常温常压下,1 NA 个CO2分子占有的体积为22.4L
D. 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲胺(CH3NH2)是一种一元弱碱,其电离方程式为:CH3NH2 + H2O ![]() CH3NH3+ + OH-。常温下,向20.0 mL 0.10 mol/L的甲胺溶液中滴加VmL0.10mol/L的稀盐酸,混合溶液的pH与相关微粒浓度的关系如图所示。下列说法中错误的是
CH3NH3+ + OH-。常温下,向20.0 mL 0.10 mol/L的甲胺溶液中滴加VmL0.10mol/L的稀盐酸,混合溶液的pH与相关微粒浓度的关系如图所示。下列说法中错误的是
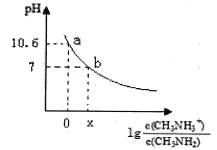
A. b点对应加入盐酸的体积V<20.00mL
B. 常温下,根据a点可知甲胺的电离平衡常数Kb=10 -3.4
C. b点可能存在关系:c(Cl-) > c(CH3NH3+) > c(H+) = c(OH-)
D. V=20.00mL时,溶液呈弱酸性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com