解答:
解:(1)一份加入足量Ba(OH)
2溶液,生成白色沉淀,过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.6g,说明含有硫酸根离子;加入NaOH溶液,一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,该气体是氨气,证明一定含有铵根离子;向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多,最后白色沉淀逐渐减少并最终消失,证明一定含有铝离子,
故答案为:NH
4+;SO
42-;
(2)由题中信息可知45.3g的该结晶水合物中:n(SO
42-)=
=0.2mol,n(NH
4+)=
=0.1 mol,根据离子化合物中阴、阳离子电荷平衡的原理:n(NH
4+)+3n(Al
3+)=2n(SO
42-)可得:n(Al
3+)=
×(2×0.2mol-0.1 mol)=0.1 mol,n(H
2O)=
| 45.3g-0.1mol×27g/mol-0.1mol×18g/mol-0.2mol×96g/mol |
| 18g/mol |
=1.2mol,该结晶水合物中:n(NH
4+):n(Al
3+):n(SO
42-):n(H
2O)=0.1mol:0.1mol:0.2mol:1.2mol=1:1:2:12,所以,该结晶水合物的化学式为NH
4Al(SO
4)
2?12H
2O[或(NH
4)
2SO
4?Al
2(SO
4)
3?24H
2O],
故答案为:0.1mol;NH
4Al(SO
4)
2?12H
2O[或(NH
4)
2SO
4?Al
2(SO
4)
3?24H
2O];
(3)①根据反应的先后顺序,开始阶段是氢氧化钡和铝离子反应生成氢氧化铝沉淀阶段,然后是铵根离子和氢氧根离子反应生成氨气和水的阶段,最后是氢氧化铝和氢氧化钡反应生成偏铝酸钡的阶段,当NH
4Al(SO
4)
2?12H
2O和氢氧化钡的物质的量之比为1:2时,两者恰好反应生成硫酸钡、氢氧化铝和一水合氨,此时生成沉淀量最大,离子反应方程式为:NH
4++Al
3++4OH
-+2Ba
2++2SO
42-=2BaSO
4↓+Al(OH)
3↓+NH
3.H
2O,n(Al
3+)=
×(2×0.2mol-0.1 mol)=0.1 mol,则n[Ba(OH)
2]=2×0.1 mol=0.2mol,v=
=
=0.1L=100mL,
故答案为:100;
②45.3g的该结晶水合物中:含有SO
42-、NH
4+、Al
3+,其物质的量分别为:0.2mol、0.1mol、0.1mol,根据反应的先后顺序,开始阶段是SO
42-+Ba
2+=BaSO
4↓,Al
3++3OH
-=Al(OH)
3↓,Al
3+完全沉淀,SO
42-未完全沉淀,然后是SO
42-完全沉淀,再次是铵根离子和氢氧根离子反应生成氨气和水的阶段,最后是氢氧化铝和氢氧根离子反应生成偏铝酸根离子的阶段,结合SO
42-~Ba
2+~BaSO
4↓,Al
3+~3OH
-~Al(OH)
3↓,
Al
3+完全沉淀,需氢氧化钡0.15mol,体积为75mL,沉淀为氢氧化铝和部分硫酸钡共0.25mol;SO
42-完全沉淀,需氢氧化钡0.2mol,体积为100mL,沉淀为氢氧化铝和全部硫酸钡共0.3mol;
Al(OH)
3↓~OH
-~[Al(OH)
4]
-,氢氧化铝溶解需0.05mol氢氧化钡,体积为125mL,沉淀为全部硫酸钡0.2mol;最后为NH
4+~OH
-,0.1molNH
4+、需0.05mol氢氧化钡,体积为150mL,所以图象为:
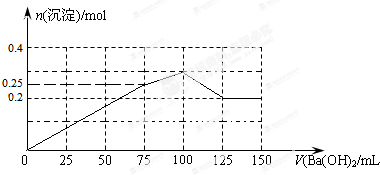
,
故答案为:

.

 ,
, .
.


 名校课堂系列答案
名校课堂系列答案
 燃煤产生的烟气中的氮氧化物NOx(主要为NO、NO2)易形成污染,必须经脱除达标后才能排放.
燃煤产生的烟气中的氮氧化物NOx(主要为NO、NO2)易形成污染,必须经脱除达标后才能排放.