
【题目】常温下,向1L 0.1mol·L1一元酸HR溶液中逐渐通入氨气(已知常温下NH3·H2O电离平衡常数K=1.76×10-5),使溶液温度和体积保持不变,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是
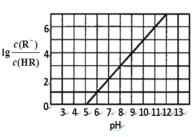
A.当c(R-)=c(HR)时,溶液必为中性
B.0.1mol·L-1HR溶液的pH为5
C.HR为弱酸,常温时随着氨气的通入,![]() 逐渐增大
逐渐增大
D.当通入0.1 mol NH3时,c(NH4+)>c(R-)>c(OH-)>c(H+)
【答案】D
【解析】
A.当c(HR)=c(R)时,lg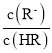 = lg1=0,如图所示,溶液的pH=5,溶液呈酸性,故A错误;
= lg1=0,如图所示,溶液的pH=5,溶液呈酸性,故A错误;
B.Ka=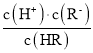 ,当lg
,当lg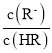 =0时,c(R)=c(HR),Ka=c(H+)=105mol/L,因为弱酸部分电离,则溶液中c(H+)≈c(R),c(HR)≈0.1mol/L,则溶液中c(H+)=
=0时,c(R)=c(HR),Ka=c(H+)=105mol/L,因为弱酸部分电离,则溶液中c(H+)≈c(R),c(HR)≈0.1mol/L,则溶液中c(H+)=![]() =
=![]() mol/L=103mol/L,溶液的pH=3,故B错误;
mol/L=103mol/L,溶液的pH=3,故B错误;
C.![]() =
=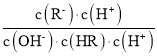 =
=![]() ,电离平衡常数、离子积常数都只与温度有关,温度不变,电离平衡常数及离子积常数不变,则
,电离平衡常数、离子积常数都只与温度有关,温度不变,电离平衡常数及离子积常数不变,则![]() 不变,故C错误;
不变,故C错误;
D.由B项可得,HR的电离平衡常数Ka=105mol/L,当通入0.1molNH3时,反应恰好生成NH4R,NH4+的水解平衡常数为Kh(NH4+)=![]() =5.68×1010,HR水解平衡常数Kh(R)=
=5.68×1010,HR水解平衡常数Kh(R)=![]() =109>5.68×1010,所以NH4+的水解程度小于R的水解程度,溶液呈碱性,溶液中存在电荷守恒:c(NH4+)+c(H+)=c(OH)+c(R),由于c(OH)>c(H+),所以c(NH+4)>c(R),则溶液中离子浓度大小为c(NH4+)>c(R)>c(OH)>c(H+),故D正确;
=109>5.68×1010,所以NH4+的水解程度小于R的水解程度,溶液呈碱性,溶液中存在电荷守恒:c(NH4+)+c(H+)=c(OH)+c(R),由于c(OH)>c(H+),所以c(NH+4)>c(R),则溶液中离子浓度大小为c(NH4+)>c(R)>c(OH)>c(H+),故D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为________。
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为
NO+NO2+2OH![]() 2
2![]() +H2O
+H2O
2NO2+2OH![]()
![]() +
+![]() +H2O
+H2O
①下列措施能提高尾气中NO和NO2去除率的有________(填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是________(填化学式);吸收后排放的尾气中含量较高的氮氧化物是________(填化学式)。
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为![]() 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
①在酸性NaClO溶液中,HClO氧化NO生成Cl和![]() ,其离子方程式为________。
,其离子方程式为________。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铝、铜三种金属元素在日常生活中的应用最为广泛。回答下列问题:
(1)基态Fe原子的简化电子排布式为__________。
(2)常温下,Fe(CO)5为黄色液体,易溶于非极性溶剂。写出CO的电子式_________;Fe(CO)5分子中σ键与π键之比为_______。
(3)硝酸铜溶于氨水形成[Cu(NH3)4](NO3)2的深蓝色溶液。
①[Cu(NH3)4](NO3)2中阴离子的立体构型是_______。NO3-中心原子的轨道杂化类型为________。
②与NH3互为等电子体的一种阴离子为_______(填化学式);氨气在一定的压强下,测得的密度比该压强下理论密度略大,请解释原因________。
(4)金属晶体可看成金属原子在三维空间中堆积而成,单质铝中铝原子采用铜型模式堆积,原子空间利用率为74%,则铝原子的配位数为________________。
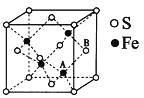
(5)铁和硫形成的某种晶胞结构如图所示,晶胞参数a=xpm,则该物质的化学式为_______;A原子距离B原子所在立方体侧面的最短距离为______pm(用x表示);该晶胞的密度为____g·cm-3。(阿伏加德罗常数用NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向一定体积0.1mol·L-1的氨水中逐滴加入等浓度的盐酸,溶液中pOH [pOH=-lg c(OH-)]与pH的变化关系如图所示。下列说法不正确的是
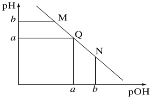
A.M点和N点溶液中H2O的电离程度相同
B.Q点溶液中,c(H+)=c(OH-),pH =7
C.M点溶液的导电性小于Q点溶液的导电性
D.N点溶液加水稀释,![]() 变小
变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒。当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流。试回答下列问题:
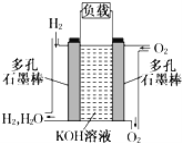
(1)图中通过负载的电子流动方向__(填“向左”或“向右”)。
(2)写出氢氧燃料电池工作时正极电极反应方程式。__。
(3)若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,负极电极反应方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素X的气态氢化物在高温下分解为固态的X单质和H2,分解反应前后气体的质量之比是17:1。下列有关叙述中错误的是
A. X的阴离子的电子排布式是1s22s22p63s23p6
B. X的最高价氧化物对应的水化物的酸性比砷酸强
C. X的最高价氧化物中,X的质量分数为50%
D. X的气态氢化物的水溶液呈酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z、R是原子序数依次增大的短周期元素。a、b、c、d、e、f是由这些元素组成的化合物,气体a的水溶液呈碱性,c为红棕色气体,f是由W、Z、R元素形成的化合物。m为元素Z形成的单质,W与X能形成化合物XW4。上述物质的转化关系如图所示,下列说法正确的是( )
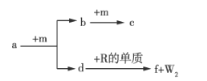
A.简单离子半径: R>Z
B.最高价氧化物对应水化物的酸性:X>Y
C.![]() 为离子化合物,含有离子键和共价键
为离子化合物,含有离子键和共价键
D.符合通式XnWn的化合物均能使溴的CCl4溶液因发生反应而褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是
A.2Na2O+2H2O=4NaOH
B.Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑
C.2Na2O2+2H2O=4NaOH+O2↑
D.NH4Cl+NaOH![]() NaCl+NH3↑+H2O
NaCl+NH3↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,它们的原子序数依次增大。已知A和C、B和D分别位于同主族,且B、D质子数之和是A、C质子数之和的2倍;![]() 在同周期元素中原子半径最小。
在同周期元素中原子半径最小。
(1)B形成的双原子分子中,共价键的类型有__,化合物A2B中B原子采取__杂化。
(2)A2B和A2D的沸点较高者是__(填化学式),其原因是_。
(3)E原子的电子排布式为__。
(4)写出均由A、B、C、D四种元素组成的两物质的浓溶液发生反应的离子方程式:__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com