
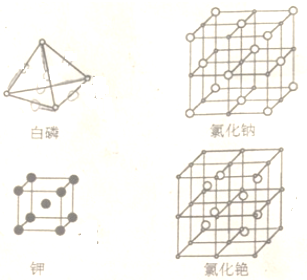
分析 (1)白磷晶体为正四面体,晶体中含有6个δ键,白磷在氧气中燃烧可以生成X、Y两种氧化物,即P4O6、P4O10;
(2)图中所给物质分别为分子晶体、金属晶体和离子晶体;
(3)根据晶胞的结构判断配位数;
(4)离子晶体的熔点高低取决于离子键的大小以及带电荷的多少.
解答 解:(1)白磷晶体为正四面体,晶体中含有6个δ键,62 g白磷(P4)的物质的量为$\frac{62g}{4×31g/mol}$=0.5mol,则含δ键的物质的量为0.5mol×6=3mol;
白磷在氧气中燃烧可以生成X、Y两种氧化物.X分子可以看成是白磷分子中每个磷磷键之间插入1个氧原子,则应插入6个O原子,X分子式为P4O6,Y分子可以看成X分子中每个磷原子再形成1个磷氧双键,则应插入4个P=O键,则Y中含有12个P-O键、4个P=O键,则Y分子中含有δ键和π键数目之比为(12+4):4=4:1,
故答案为:3mol;P4O6;4:1;
(2)图中所给物质分别为分子晶体、金属晶体和离子晶体,没有的为原子晶体,故答案为:原子晶体;
(3)从CsCl晶体结构图中分割出来的部分结构图为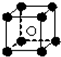 ,则由图可知在CsCl晶体中每个Cs+周围都紧邻8个Cl-,
,则由图可知在CsCl晶体中每个Cs+周围都紧邻8个Cl-,
已知氯化钠的晶胞图为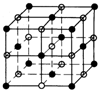 ,晶体中每个Na+周围距离最近且相等的Na+共有12个,
,晶体中每个Na+周围距离最近且相等的Na+共有12个,
由钾的晶胞可知钾位于定点和体心,则配位数为8,
故答案为:钾、氯化铯;
(4)因离子半径Cs+>Na+,且离子所带电荷相等,则离子半径越大,晶格能越小,离子晶体的熔点越低,所以熔点较高的是氯化钠晶体,故答案为:氯化钠晶体.
点评 本题多角度考查晶体知识,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握晶体的类型和性质的关系以及晶胞的计算方法,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 厨房中用的食盐、食醋都是电解质 | |
| B. | 古代的陶瓷、砖瓦、现代的玻璃、水泥等,都是硅酸盐产品 | |
| C. | 石油的分馏、煤的干馏、石油的裂解都是化学变化 | |
| D. | 工业上通过电解熔融的氯化物制取Na、Mg、Al三种金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、Na+、I-、Fe3+ | B. | Mg2+、Cl-、NO3-、Al3+ | ||
| C. | K+、Cl-、HCO3-、SO42- | D. | Ba2+、Na+、Cl-、[Al(OH)4]- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
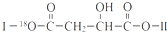 (其中Ⅰ、Ⅱ为未知部分的结构).下列是X发生反应的转化关系图及E的信息.
(其中Ⅰ、Ⅱ为未知部分的结构).下列是X发生反应的转化关系图及E的信息.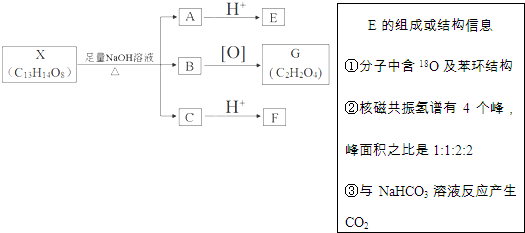
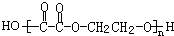 +(2n-1)H2O
+(2n-1)H2O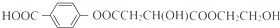 +4NaOH$→_{△}^{水}$
+4NaOH$→_{△}^{水}$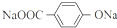 +NaOOCCH2CH(OH)COOONa+HOCH2CH2OH+2H2O
+NaOOCCH2CH(OH)COOONa+HOCH2CH2OH+2H2O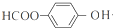 等
等查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径X>Y | B. | 氢化物稳定性H2X>HY | ||
| C. | 原子核内质子数R<M | D. | 溶液碱性ROH<MOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 保持温度不变,缩小容器的体积,平衡向逆反应方向移动,再次达到平衡时气体的颜色变浅了 | |
| B. | 若保持恒温恒压,再充入一定量的NO2气体,当容器的体积不再变化时表明重新达到平衡状态 | |
| C. | 保持容器的体积不变,升高温度,正反应速率加快,逆反应速率减慢,平衡向正反应方向移动 | |
| D. | 恒温恒容条件下,再充入一定量的N2O4,达到新平衡时NO2的体积分数比原平衡的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 卤素单质氧化性F2>Cl2>Br2>I2,因此排在前面的卤素单质均可将排在后面的卤素从它的盐溶液中置换出来 | |
| B. | 卤族元素从C1到I,最高价氧化物对应水化物的酸性减弱 | |
| C. | 卤族元素从F到I,HX水溶液酸性增强 | |
| D. | 卤素单质从F2到I2颜色加深,熔沸点升高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com