
中石化于2012年将年产120万吨的乙烯工程落户大庆,乙烯是有机化工工业的重要原料,有很多重要用途。如:乙烯催化氧化成乙醛可设计成如下图所示的燃料电池,在制备乙醛的同时还可获得电能,其总反应化学方程式为:2CH2=CH2+O2→2CH3CHO。下列有关说法正确的是
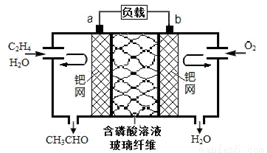
A. 该电池电极a为正极,b为负极
B. 电子移动方向:电极a→磷酸溶液→电极b
C. 负极反应式为:CH2=CH2-2e-+H2O=CH3CHO+2H+
D. b电极有2.24LO2反应,溶液中有0.4molH+迁移到b电极上反应
科目:高中化学 来源:2017届山东省菏泽市高三一模理综化学试卷(解析版) 题型:选择题
常温下,用0.10mol·L-1的NaOH溶液分别滴定体积均为50.00mL、浓度均为0.05mol·L-1的HClO、HF两种溶液,其滴定曲线如图所示。
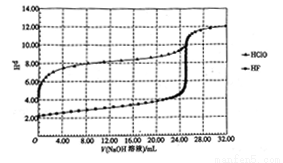
下列说法正确的是
A. HClO的酸性比HF强
B. V(NaOH溶液)=0 mL 时,对应溶液中:c(ClO-)=c(F-)
C. V(NaOH溶液)=12.50 mL 时,对应溶液中:c(ClO-)>c(F-)
D. V(NaOH溶液)=25.00mL时,对应溶液中:c(ClO-)<c(F-)
查看答案和解析>>
科目:高中化学 来源:2017届浙江省宁波市高三新高考选考适应性考试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 足量Mg与2.8gN2完全反应后失去0.2NA电子
B. 3.0g由葡萄糖和冰醋酸组成的混合物中含有的原子总数为0.3NA
C. 常温常压下,2.8gC2H4含有共用电子对的数目为0.6NA
D. 16gO2含有NA个18O原子
查看答案和解析>>
科目:高中化学 来源:2017届浙江省宁波市高三新高考选考适应性考试化学试卷(解析版) 题型:选择题
下列物质的水溶液因水解而呈碱性的是
A. NaOH B. NH4Cl C. NaCl D. Na2CO3
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省大庆市高三第二次教学质量检测(二模)理科综合化学试卷(解析版) 题型:简答题
随着科学技术的发展和环保要求不断提高,CO2的捕集利用技术成为研究的重点。
I.工业上使用的捕碳剂有NH3和(NH4)2CO3,它们与CO2可发生如下可逆反应:
NH3(l)+H2O(l)+CO2(g)  NH4HCO3(aq) ΔH1
NH4HCO3(aq) ΔH1
2NH3(l)+H2O(l)+CO2(g)  (NH4)2CO3(aq) ΔH2
(NH4)2CO3(aq) ΔH2
(NH4)2CO3(aq)+H2O(l)+CO2(g)  2NH4HCO3(aq) ΔH3
2NH4HCO3(aq) ΔH3
则ΔH3 =______(用含ΔH1 、ΔH2 的代表式表示)。
II.目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的化学反应方程式为:CO2 (g)+4H2(g)  CH4(g)+2H2O(g),已知:H2的体积分数随温度的升高而增加。
CH4(g)+2H2O(g),已知:H2的体积分数随温度的升高而增加。
(1)该反应的ΔS_____0(填“>”、“=”、“<”),该反应的ΔH____0(填“>”、“<”)。
(2)在恒容密闭容器中通入等物质的量的CO2和H2并发生上述反应,温度T下,CO2物质的量浓度c(CO2)随时间t变化的曲线如下图所示。下列能说明反应达到平衡状态的是___。
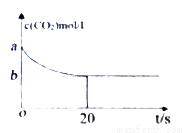
A.体系压强保持不变
B.混合气体密度保持不变
C.甲烷和水蒸气的物质的量之比保持不变
D.H2的质量分数保持不变
(3)温度T下,反应前20秒的平均速率v(H2)= _________(用含a、b的代数式表示)。
(4)温度T下,该反应的平衡常数K=_________(用含a、b的代数式表示)。
(5)若降低温度,反应重新达到平衡,则v(正)_________;CO2转化率_________(填“增大”“减小”或“不变”)。
III.工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如下:
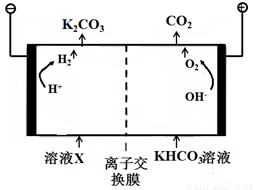
①在阳极区发生的反应包括_________和H++HCO3-=CO2↑+H2O。
②简述CO32-在阴极区再生的原理:_________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省四地六校高二下学期第一次联考(3月)化学试卷(解析版) 题型:
为了探究甲烷和氯气反应的情况,某研究小组设计了几个实验。请填写下列空白:
【实验一】用如图所示装置,用排水法往量筒中先后充入氯气和甲烷气体(各占50%),光照后观察到量筒内有油状液体生成,并形成一段水柱,认为有氯化氢生成。
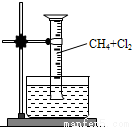
(1)该反应的化学方程式为_________________________;(只写第一步)
(2)水槽中盛放的液体最好为_________________________;(填标号)
A.水 B.饱和石灰水 C.饱和食盐水 D.饱和NaHCO3溶液
【实验二】用排蒸馏水法往量筒中先后充入氯气和甲烷气体(各占50%)收集一试管混合气体,光照反应后,往水槽中滴加AgNO3溶液,看到有白色沉淀生成,认为有氯化氢生成。
(3)该实验设计的不合理之处:___________________________________________________;
【实验三】
步骤一:收集半试管氯气,加入10mL蒸馏水,充分振荡,采用DIS系统的pH传感器测溶液的pH(下同)。测得pH=3.26。
步骤二:收集一试管甲烷和氯气的混合气体(各占50%),在40W的日光灯下光照6min后,加入10mL蒸馏水,充分振荡,测得pH=1.00。
(4)判断该反应中有氯化氢生成的依据是_______________________________________;
(5)假设氯气完全参与反应,且不考虑氯气溶解于水。往反应后的溶液中加水稀释到100.00mL,取20.00mL稀释液,加入10.00mL浓度为0.01mol•L-1的AgNO3溶液恰好完全反应,则试管中原有氯气在标准状况下的体积为____________mL。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省四地六校高二下学期第一次联考(3月)化学试卷(解析版) 题型:选择题
1mol某链烃跟2mol HCl加成生成卤代烷,生成的卤代烷跟Cl2发生取代反应,若卤代烷与Cl2的物质的量之比为1:10发生完全取代,生成只含两种元素的有机物,则该烃是( )
A. 1,3-丁二烯 B. 2-戊烯
C. 1-丁炔 D. 异戊二烯
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省四地六校高一下学期第一次联考(3月)化学试卷(解析版) 题型:简答题
I.某次采集酸雨样品,每隔一段时间测定一次pH,得到数据如下:
时间 | 开始 | 8小时 | 16小时 | 24小时 | 32小时 | 40小时 | 48小时 |
pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
(1)放置时,雨水样品酸性_______________(填“增强”、“减弱”或“不变”)。
酸性变化的原因_________________________________(用化学方程式表示)。
II.汽车尾气(含有烃类、CO、SO2与NO等物质)是城市空气的污染源。冶理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的转化。
(2) 写出一氧化碳与一氧化氮反应的化学方程式:__________________________。
(3) 在“催化转化器”转化后的气体中有CO2、SO2,下列不能鉴别这两种气体的是(____)
A.KMnO4溶液 B.石灰水 C.BaCl2溶液 D.品红溶液
(4) 有效减少城市污染的方法可以有____________
A. 开发氢能源 B. 使用电动车 C. 植树造林 D. 戴上呼吸面具
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省长沙市高二下学期第一次月考化学试卷(解析版) 题型:推断题
某单烯烃Q的相对分子质量为56,分子中含有支链。
(1)Q的结构简式为_____________。
(2)在锂离子电池中,需要一种有机聚合物作为正负极之间锂离子迁移的介质,该有机聚合物的单体之—(用M表示)的结构简式如图: 。M的合成方法之一如下:
。M的合成方法之一如下:

请回答下列问题:
①合成M的反应中,反应I的反应类型是________,试剂II是_________。
②E的结构简式是_________。
③M与足量氢氧化钠溶液反应的化学方程式是_________________。
(3)D在一定条件下能发生缩聚反应生成高聚物,请写出D发生缩聚反应的化学方程式:__________。
(4)已知:(其中R为烃基)
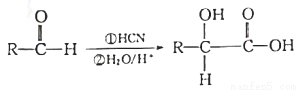
若 ,请写出符合下列条件,且与W互为同分异构体的物质的一种结构简式:_______。
,请写出符合下列条件,且与W互为同分异构体的物质的一种结构简式:_______。
a.碳骨架与W相同;
b.能发生银镜反应;
c.1 mol该物质与足量金属钠作用生成1.5 mol H2 ;
d.分子中毎个碳原子上不同时连有两个官能团
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com