
【题目】如图容器底部是培养基,其中含有植物生长所需的全部养分,如果有人在配制培养基的矿质元素中使用了NH4NO3、KNO3、CaCl2·2H2O、MgSO4·7H2O、螯合铁溶液、微量元素溶液,但缺少了一种必需元素,为补充这种元素,应添加的化合物是( )
A.Ca(NO3)2B.KClC.KH2PO4D.K2SO4
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】海水中溴元素以Br﹣形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如下图:
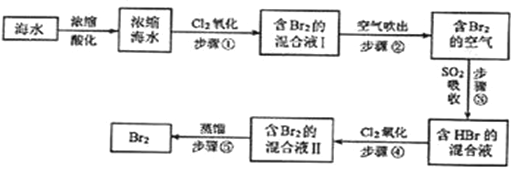
请回答下列问题.
(1)将海水浓缩的方法是__;
(2)步骤①反应的离子方程式是__,1molCl2参加反应,转移电子__mol;
(3)步骤②通入热空气吹出Br2,利用了Br2的__(填序号);
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(4)步骤③中用SO2的水溶液吸收Br2,吸收率可达95%,该反应的氧化剂是__,在工业生产中此步骤应解决的问题是__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2H2O2(l)═2H2O(l)+O2(g)反应过程中的能量变化曲线如图所示,下列说法不正确的是

A. 途径Ⅱ与途径Ⅰ相比,可能是加入了二氧化锰
B. 2molH2O2(l)的能量高于2molH2O(l)的能量
C. 其他条件相同,产生相同量氧气时放出的热量:途径Ⅰ大于途径Ⅱ
D. 其他条件相同,产生相同量氧气耗时:途径Ⅰ大于途径Ⅱ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出)。已知H为固态氧化物,F是红褐色难溶于水的沉淀,且A、B、C、D、E、F六种物质中均含同一种元素。

请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含的同一种元素的名称是________。
(2)反应①的化学方程式为_____________________________________
反应③的离子方程式为________________________
反应⑧的化学方程式为_____________________________________
(3)反应⑥过程中的现象是______________________________。
(4)1molI发生反应后生成的A高温下与足量的水蒸气反应,生成的气体换算成标准状况下占______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.如图所示的是探究金属腐蚀条件的实验装置图,请分析实验并回答下列问题:

(1)若起始时甲、乙、丙3套装置的导管中液面高度相同,过一段时间后液面最高的是________。
(2)通过甲、乙装置的对比说明钢铁中碳的含量越________(填“高”或“低”),钢铁越易腐蚀。
(3)乙装置中发生电化学腐蚀时正极的电极反应式为_________________________________。
Ⅱ.利用化学反应:2FeCl3+Cu=2FeCl2+CuCl2,请你选择合适的电极材料和电解质溶液,设计一个原电池。可供选择的电极材料:铁棒、铜棒、石墨棒。可供选择的电解质溶液:CuCl2溶液、FeCl2溶液、FeCl3溶液。
请填写下列空白:
(1)选择________作正极材料,________作负极材料;选择________作电解质溶液。
(2)写出有关的电极反应式:正极:__________________;负极:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2是制造干电池的主要原料之一,也是中学化学中常见的一种试剂。工业上Mn(NO3)2和KMnO4为原料制备MnO2,其生产原理如下:用软锰矿(含MnO2和少量的Fe2O3、SiO2)和碳反应制得MnO;再将MnO与稀硝酸反应,反应后经过滤、提纯、浓缩,可制得50%的Mn(NO3)2溶液;在一定条件下,把50%的Mn(NO3)2溶液滴加到KMnO4溶液中,发生如下反应:3Mn(NO3)2+2KMnO4+2H2O═5MnO2↓+2KNO3+4HNO3,反应生成的沉淀经过滤、洗涤、干燥后得到MnO2。
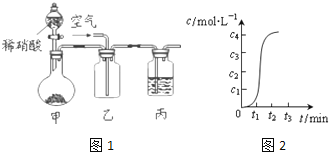
请回答下列问题:
Ⅰ、若将软锰矿和碳反应后的固体产物置于如图1所示的装置甲中,与稀硝酸反应,观察到装置乙中有红棕色气体产生。
(1)写出甲中产生气体反应的化学方程式___。
(2)在制备MnO2的实验中要向反应混合液中不断滴加氨水,则氨水的作用是___。
Ⅱ、有人提出用日光分解KMnO4溶液的方法可制取MnO2,反应方程式为:4KMnO4+2H2O![]() 4MnO2↓+4KOH+3O2↑该反应中c(OH-)随时间的变化曲线如图2所示,分析曲线的变化趋势,你认为形成该变化的原因是___。
4MnO2↓+4KOH+3O2↑该反应中c(OH-)随时间的变化曲线如图2所示,分析曲线的变化趋势,你认为形成该变化的原因是___。
Ⅲ、某兴趣小组通过实验研究MnO2的氧化性进行了一系列的研究。
(1)该小组设计了如下4个方案以验证MnO2的氧化性,可行的是___。
A.把MnO2固体加入到FeSO4溶液中,再加入KSCN溶液,观察溶液是否变红
B.把MnO2固体加入到FeCl3溶液中,再加入KSCN溶液,观察溶液是否变红
C.把MnO2固体加入到Na2SO3溶液中,再加入BaCl2观察是否有白色沉淀生成
D.把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成
(2)该小组为研究在不同酸碱性的溶液中MnO2的氧化能力,他们控制KI溶液的浓度和MnO2固体的质量相同,恒定实验温度在298K,设计如下对比试验。
实验 | 酸或碱 | 现象 |
A | 1滴0.2mol/LNaOH溶液 | 不变色 |
B | 1滴水 | 缓慢变浅棕褐色 |
C | 1滴0.1mol/L硫酸溶液 | 迅速变棕褐色 |
该小组从上述对比实验中,可以得出的结论是___。写出在MnO2迅速氧化I的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原子序数的说法正确的是
A. 原子序数是按照元素在周期表中的顺序给元素所编的号码
B. 元素的原子序数一定等于其原子相对质量
C. 元素的原子序数一定等于其最外层电子数
D. 元素的原子序数一定等于其核内中子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将一块未打磨过的铝片放入装有少量NaOH溶液的试管中,会发现开始没有气泡,一段时间后才产生气泡。请写出发生反应的离子方程式:___________,___________。
(2)将8gFe2O3投入到150mL某浓度的稀H2SO4中,再投入7g铁粉收集到1.68LH2(标准状况),同时,Fe与Fe2O3均无剩余,为了中和过量的硫酸,且使溶液中铁元素完全沉淀,共消耗4mol/L的NaOH溶液150mL。则原硫酸的物质的量浓度为________。
(3)请写出制备漂白粉的离子方程式:____________。
(4)配平下列离子方程式:______Fe(OH)3+ClO-+OH-=FeO42-+Cl-+H2O。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com