
下列化学用语表示正确的是
A.表示氢气燃烧热的热化学方程式:2H2(g)+O2(g)= 2H2O(1)△H= -571.6kJ/mol
B.肥皂(主要成分为RCOONa)的水溶液显碱性:RCOO-+H2O RCOOH+OH-
RCOOH+OH-
C.实验室制氯气的离子方程式:MnO2+4H++4Cl- MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
D.乙酸与乙醇反应的化学方程式:CH3CO18OH+C2H5OH CH3CO18OC2H5+H2O
CH3CO18OC2H5+H2O
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源:2014高考名师推荐化学--预测14 题型:实验题
苯甲酸广泛应用于制药和化工行业,某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸(KMnO4中性条件下还原产物为MnO2,酸性条件下为Mn2+)

已知:苯甲酸相对分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3 g和6.9 g。

实验流程:
①往装置A中加入2.7mL(2.3 g)甲苯和125 mL水,然后分批次加入8.5 g稍过量的KMnO4固体,控制反应温度约在100℃,当甲苯层近乎消失,回流不再出现油珠时,停止加热。
②将反应混合物趁热过滤,用少量热水洗涤滤渣,合并滤液与洗涤液,冷却后加入浓盐酸,经操作I得白色较干燥粗产品。
③纯度测定:称取1.220g白色样品,配成100mL,甲醇溶液,取25.00mL溶液,用0.1000mol/L KOH标准溶液滴定,重复滴定四次,每次消耗的体积如下表所示列举:
| 第一次 | 第二次 | 第三次 | 第四次 |
体积(mL) | 24.00 | 24.10 | 22.40 | 23.90 |
请回答:
(1)装置A的名称 。若不用温度计,本实验控制反应温度的措施为 。
(2)白色粗产品中除了KCl外,其他可能的无机杂质为 。
(3)操作I的名称 。
(4)步骤③中用到的定量仪器有 ,100mL容量瓶,50mL酸式、碱式滴定管。
(5)样品中苯甲酸纯度为 。
(6)滴定操作中,如果对装有KOH标准溶液的滴定管读数时,滴定前仰视,滴定后俯视则测定结果 (填“偏大”、“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测12 题型:简答题

(1)若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质,加热蒸干B的溶液不能得到B,则B的化学式可能是 ,工业上制取A的离子方程式Ⅰ为 。
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则反应①的化学方程式为 。
(3)若D是氯碱工业的主要产品,B有两性,则反应②的离子方程式是 。
(4)若A、C、D都是常见气体,C是形成酸雨的主要气体,则反应③的化学方程式 ;
(5)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上.在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。

(6)Ⅰ①图中X、Y分别是 (填化学式),分析比较图示中氢氧化钠质量分数a% b%(填“>”、“=”或“<”)
②写出燃料电池B中负极上发生的电极反应 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测12 题型:选择题
硼酸(H3BO3)溶液中存在如下反应:H3BO3(aq)+H2O(l)  ?[B(OH)4]-(aq)+H+(aq)。下列说法正确的是
?[B(OH)4]-(aq)+H+(aq)。下列说法正确的是
化学式 | 电离常数(298 K) |
H3BO3 | K=5.7×10-10 |
H2CO3 | K1=4.4×10-7 K2=4.7×10-11 |
CH3COOH | K=1.75×10-5 |
A.将一滴碳酸钠溶液滴入硼酸溶液中一定能观察到有气泡产生
B.将一滴醋酸溶液滴入碳酸钠溶液中一定能观察到有气泡产生
C.等物质的量浓度的碳酸溶液和硼酸溶液比较,pH:前者>后者
D.等物质的量浓度的碳酸钠溶液和醋酸钠溶液比较,pH:前者>后者
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测11 题型:推断题
【化学与技术】
钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染。

请回答下列问题:
(1)Fe的原子序数为26,其最外层电子数为2,请写出铁原子结构示意图____。
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式 。
(3)氯碱厂获得Cl2的离子方程式为 。

(4)由TiCl4→Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
(5)为了减少产业链生产时产生的工业三废对环境的威胁,当NaCl与FeTiO3的物质的量之比为 时,理论上Cl2的利用率最大。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测11 题型:选择题
下列在指定溶液中的各组离子,能够大量共存的是
A.使无色酚酞变红的溶液中:S2—、K+、CO32—、C1—
B.1mol·L—1的氯化铁溶液中:Na+、C1—、SCN—、Cu2+
C.PH=0的溶液中:S2—、I—、Mg2+、Ba2+
D.水电离的C(H+)=10—13mol·L—1的溶液中:Fe2+、SO42—、K+、NO3—
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测10 题型:推断题
镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、炭粉、氧化铁等涂覆在铝箔上制成.由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行资源回收研究,并设计出相关实验流程图
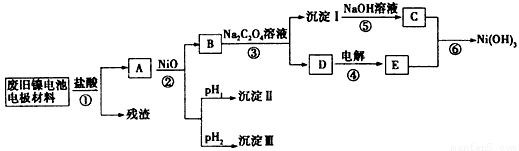
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+
②某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如表所示:

回答下列问题:
(1)根据表数据判断步骤②依次析出沉淀Ⅱ 和沉淀Ⅲ (填化学式),则pH1 pH2(填填“>”、“=”或“<”),控制两种沉淀析出可利用 。
A.pH试纸 B.石蕊指示剂 C.pH计
(2)已知溶解度:NiC2O4>NiC2O4?H2O>NiC2O4?2H2O,则反应③的化学方程式是 。第③步反应后,过滤沉淀时需要的玻璃仪器有 。若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因 、 。
(3)④中阳极反应产生的气体E为 ,验证该气体的试剂为 。
(4)试写出反应⑥的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测10 题型:选择题
下列叙述正确的是
A.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极区产生的Cl2进入阳极区
B.电解精炼铜时,反应开始一段时间内阳极溶解铜的质量比阴极析出铜的质量大
C.海轮外壳上镶入锌块,可减缓船体的腐蚀
D.在铁片上镀铜时,若铁片增重3.2g,则电路中通过的电子的物质的量为0.05mol
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--线索综合2 题型:简答题
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤,已知
SO2(g)+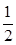 O2(g)
O2(g) SO3(g)△H=-98 kJ·mol-1。
SO3(g)△H=-98 kJ·mol-1。
(1)某温度下该反应的平衡常数K= ,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol
,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol
SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v正 v逆(填“<”、“>”或“=”)。
(2)一定温度下,向一带活塞的体积为2 L的密闭容器中充入2.0 mol SO2和1.0 molO2,达到平衡后体积变为1.6 L,则SO2的平衡转化率为 。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是 (填字母)。
A保持温度和容器体积 不变,充入1.0 mol O2
不变,充入1.0 mol O2
B保持温度和容器内压强不变,充入1.0 mol SO3
C降低 温度
温度
D移动活塞压缩气体
(4)若以右图所示装置,用电化学原理生产硫酸,写出通入O2电极的电极反应式为 。

(5)为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com