
| A、配制盐酸溶液用量筒量取盐酸时俯视刻度线 |
| B、浓H2SO4稀释后未经冷却即注入容量瓶配制 |
| C、配制100mL1mol/L Na2CO3溶液时,砝码放在托盘天平左盘 |
| D、配制盐酸溶液定容时,仰视容量瓶刻度线 |
| n |
| V |
| n |
| V |
| n |
| V |
| n |
| V |
| n |
| V |


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
| 微粒 | 孤电子对数 | 杂化轨道数 | 中心原子轨道杂化形式 | 微粒的空间构型 |
| SO2 | ||||
| NH4+ | ||||
| CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
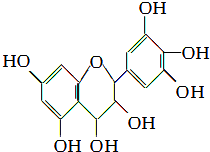 从葡萄籽中提取的原花青素结构为:原花青素具有生物活性,如抗氧化和自由基清除能力等,可防止机体内脂质氧化和自由基的产生而引发的肿瘤等多种疾病.有关原花青素的下列说法不正确的是( )
从葡萄籽中提取的原花青素结构为:原花青素具有生物活性,如抗氧化和自由基清除能力等,可防止机体内脂质氧化和自由基的产生而引发的肿瘤等多种疾病.有关原花青素的下列说法不正确的是( )| A、该物质既可看作醇类,也可看作酚类 |
| B、1 mol该物质可与4 mol Br2反应 |
| C、1 mol该物质可与7 mol NaOH反应 |
| D、1 mol该物质可与7 mol Na反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 用于制取、并收集表格中的四种气体(a、b、c表示相应仪器中加入的试剂)其中可行的是( )
用于制取、并收集表格中的四种气体(a、b、c表示相应仪器中加入的试剂)其中可行的是( )| 选项 | 气体 | a | b | c |
| A | NO2 | 浓硝酸 | 铜片 | NaOH溶液 |
| B | SO2 | 浓硫酸 | Cu | 酸性KmnO4溶液 |
| C | NH3 | 浓氨水 | NaOH固体 | 氧化钙 |
| D | CO2 | 稀盐酸 | CaCO3 | 碱石灰 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子中3个碳原子在同一直线上 |
| B、能使酸性KMnO4溶液褪色 |
| C、分子中所有原子在同一平面上 |
| D、与氯化氢加成只生成一种产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化铝溶液与过量氨水反应:3OH-+Al3+═Al(OH)3↓ |
| B、铜溶于稀硝酸:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
| C、FeCl3溶液与Cu粉反应:Cu+Fe3+═Cu2++Fe2+ |
| D、次氯酸钙溶液中通入过量CO2:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com