


科目:高中化学 来源: 题型:
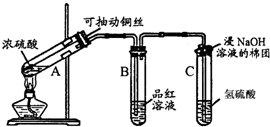
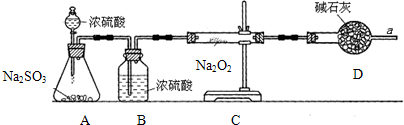
 氮的化合物在无机化工领域有着重要的地位.请回答下列问题:
氮的化合物在无机化工领域有着重要的地位.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
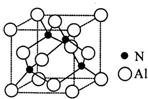
 有关元素A、B、C、D的信息如下:
有关元素A、B、C、D的信息如下:| 元素 | 有关信息 |
| A | 最高价氧化物对应的水化物(甲)能与其气态氢化物(乙)反应生成盐 |
| B | 地壳中含量最高的元素,A与B可形成一种质量比为7:12的化合物(丙) |
| C | 单质曾用于焊接钢轨 |
| D | 单质是生活中常见金属,其制品在自然环境中被腐蚀呈现红棕色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
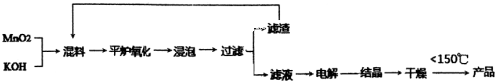

查看答案和解析>>
科目:高中化学 来源: 题型:
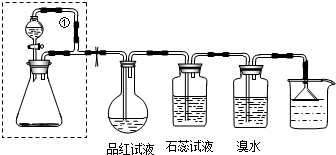
查看答案和解析>>
科目:高中化学 来源: 题型:
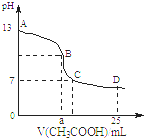 25℃时,在25mL0.1mol/L的氢氧化钠溶液中,逐滴加入0.2mol/LCH3COOH,溶液的pH的变化曲线如图所示,下列分析的结论正确的是( )
25℃时,在25mL0.1mol/L的氢氧化钠溶液中,逐滴加入0.2mol/LCH3COOH,溶液的pH的变化曲线如图所示,下列分析的结论正确的是( )| A、若B点的横坐标a=12.5,且有c(Na+)=c(CH3COO-) |
| B、对曲线上A、B间任何一点,溶液中都有:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| C、D点时,c(CH3COO-)+c(CH3COOH)=c(Na+) |
| D、C点时,c(CH3COO-)=c(Na+)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某酸性溶液中只含NH4+、Cl-、H+、OH-四种离子,溶液中一定存在:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| B、物质的量浓度相同的4种溶液:①CH3COONa;②NaNO3;③Na2CO3;④NaOH,pH的大小顺序是:④>③>①>② |
| C、在Na2CO3和NaHCO3的混合溶液中:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-) |
| D、25℃时,pH=10的CH3COONa溶液与pH=10的氨水中,由水电离出的c(OH-)之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/L NaHCO3溶液中:c(H+)+c(Na+)=c(OH-)+c(HCO3-)+c(CO32-) |
B、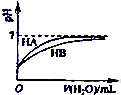 表示常温下,稀释HA、HB两种酸的稀溶液时,溶液PH随加水量的变化,则NaA溶液的PH大于同浓度的NaB溶液的PH |
C、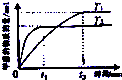 表示在其他条件相同时,分别在T1、T2温度下由CO2和H2合成甲醇的物质的量随时间变化情况,则CO2和H2合成甲醇是放热反应 |
D、 表示将1.000 mol/L氨水滴入20.00mL1.000 mol/L盐酸中,溶液PH和温度随加入氨水体积变化曲线 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲烷、苯、乙醇和乙酸在一定条件下都能发生取代反应 |
| B、乙烯使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色的反应类型不同 |
| C、塑料、合成橡胶、合成纤维都属于合成有机高分子材料 |
| D、化学式均为(C6H10O5)n的淀粉和纤维素互为同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com