
雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl-。某同学收集了该地区的雾霾,经必要的预处理后试样溶液,设计并完成了如下的实验:
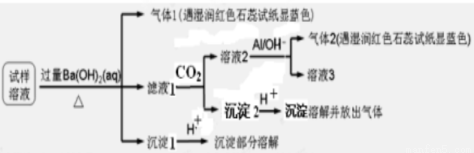
已知:3NO3-+8Al+5OH-+2H2O 3NH3+8AlO2-
3NH3+8AlO2-
根据以上的实验操作与现象对下列说法进行判断:
(1)试样中肯定存在的离子是_________________________
(2)沉淀1的成分为_______________________________
(3)下列说法正确的是( )
A.该雾霾中可能存在NaNO3、NH4Cl、MgSO4
B.试样中一定不含Al3+
C.PM2.5表示每立方米空气中直径小于或等于2.5微米的颗粒物,PM2.5分散在空气中形成的混合物属于胶体
D.大量燃烧化石燃料是造成雾霾天气的一种重要因素
(4)Al3+可以与碱反应生成Al(OH)3沉淀,写出实验室制取Al(OH)3的离子方程式:_____________________。
(1)NH4+ Mg2+ SO42- NO3- (2)BaSO4 Mg(OH)2 (3)A、C、D
(4)Al3++3NH3·H2O=Al(OH)3↓+3NH4+
【解析】
试题分析:气体1和气体2是氨气,故溶液中一定含有NH4+,生成沉淀1遇酸部分溶解成分是氢氧化镁和硫酸钡,故一定含有Mg2+、SO42-。3NO3-+8Al+5OH-+2H2O 3NH3+8AlO2-生成气体2氨气,故溶液2中含有NO3-。沉淀2遇酸沉淀溶解并放出气体,沉淀2是碳酸钡。试样溶液如存在Al3+,加入过量Ba(OH)2溶液,在滤液1中有AlO2-,通入CO2,沉淀2一定会有BaCO3,可能有Al(OH) 3,再加酸,现象仍是“沉淀溶解并放出气体”。故试样中可能含Al3+。所以(1)根据上述一定含有的离子是NH4+ Mg2+ SO42- NO3-;(2)沉淀遇到酸部分溶解沉淀1成分是BaSO4 、Mg(OH)2;(3)A. 在溶液中存在NH4+ Mg2+ SO42- NO3-,所以该雾霾中可能存在NaNO3、NH4Cl、MgSO4,正确;B、通过上述分析可知在试样中可能含有铝离子,故B错误;C. PM2.5表示每立方米空气中直径小于或等于2.5微米的固体颗粒物,PM2.5分散在空气中分散剂为空气,则PM2.5可能导致空气形成气溶胶,正确;D. 大量燃烧化石燃料就会产生许多固体颗粒,因此是造成雾霾天气的一种重要因素,正确。(4)Al3+可以与碱反应生成Al(OH)3沉淀,由于Al(OH)3两性,能够与强碱发生反应而溶解,所以在实验室制取Al(OH)3的时候应该用弱碱来制取,相应的离子方程式是Al3++3NH3·H2O=Al(OH)3↓+3NH4+。
3NH3+8AlO2-生成气体2氨气,故溶液2中含有NO3-。沉淀2遇酸沉淀溶解并放出气体,沉淀2是碳酸钡。试样溶液如存在Al3+,加入过量Ba(OH)2溶液,在滤液1中有AlO2-,通入CO2,沉淀2一定会有BaCO3,可能有Al(OH) 3,再加酸,现象仍是“沉淀溶解并放出气体”。故试样中可能含Al3+。所以(1)根据上述一定含有的离子是NH4+ Mg2+ SO42- NO3-;(2)沉淀遇到酸部分溶解沉淀1成分是BaSO4 、Mg(OH)2;(3)A. 在溶液中存在NH4+ Mg2+ SO42- NO3-,所以该雾霾中可能存在NaNO3、NH4Cl、MgSO4,正确;B、通过上述分析可知在试样中可能含有铝离子,故B错误;C. PM2.5表示每立方米空气中直径小于或等于2.5微米的固体颗粒物,PM2.5分散在空气中分散剂为空气,则PM2.5可能导致空气形成气溶胶,正确;D. 大量燃烧化石燃料就会产生许多固体颗粒,因此是造成雾霾天气的一种重要因素,正确。(4)Al3+可以与碱反应生成Al(OH)3沉淀,由于Al(OH)3两性,能够与强碱发生反应而溶解,所以在实验室制取Al(OH)3的时候应该用弱碱来制取,相应的离子方程式是Al3++3NH3·H2O=Al(OH)3↓+3NH4+。
考点:考查溶液中含有的离子的确定、化学方程式、离子方程式的书写、物质的制取的知识。


科目:高中化学 来源:2015届安徽省江淮十校高三11月联考化学试卷(解析版) 题型:选择题
根据下图海水综合利用的工业流程图,判断下列说法正确的是
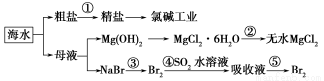
已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。
A.除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B.在过程②中将MgCl2·6H2O灼烧即可制得无水MgCl2
C.从能量角度来看,氯碱工业中的电解饱和食盐水是一个将化学能转化为电能的过程
D.从第③步到第⑤步的目的是为了浓缩富集溴
查看答案和解析>>
科目:高中化学 来源:2015届宁夏银川市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列物质与常用危险化学品的类别不对应的是
A.H2SO4、NaOH——腐蚀品 B.CH4、C2H4——易燃液体
C.CaC2、Na——遇湿易燃物品 D.KMnO4、K2Cr2O7——氧化剂
查看答案和解析>>
科目:高中化学 来源:2015届宁夏高三上学期期中考试理科综合化学试卷(解析版) 题型:填空题
现有下列化合物①NaCl、②NaOH、③HCl、④NH4Cl、⑤CH3COONa、⑥CH3COOH、⑦NH3·H2O、⑧H2O,回答问题:
(1)NH4Cl溶液显________性,用离子方程式表示___________ _____________。
(2)已知水中存在如下平衡:H2O+H2O HO+OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,选择的方法是________。
HO+OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,选择的方法是________。
A.向水中加入NaHSO4固体
B.向水中加入Na2CO3固体
C.加热至100 ℃
D.向水中加入(NH4)2SO4固体
(3)若等pH、等体积的②(NaOH)和⑦(氨水)分别加水稀释m倍、n倍,稀释后pH相等,则m________n(填“>”“<”或“=”)。
(4)pH=12的NaOH溶液100mL,要使它的pH为11。(体积变化忽略不计)
如果加入蒸馏水,应加_________mL;如果加入pH=10的NaOH溶液,应加_________mL;
如果加0.01mol/L HCl,应加_________mL。
查看答案和解析>>
科目:高中化学 来源:2015届宁夏高三上学期期中考试理科综合化学试卷(解析版) 题型:选择题
电解饱和食盐水,当阴极附近有0.4 mol NaOH生成时,阳极放出
A.0.2 mol H2 B.0.2 mol Cl2
C.O.4 mol H2 D.0.4 mol Cl2
查看答案和解析>>
科目:高中化学 来源:2015届天津一中高三化学9月考化学试卷(解析版) 题型:选择题
下列关于有机物的说法不正确的是()
A.某甲酸溶液中可能存在着甲醛,加入新制的Cu(OH)2加热,有砖红色沉淀产生,证明一定存在甲醛
B.有机物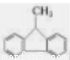 的所有碳原子可能处在同一平面上
的所有碳原子可能处在同一平面上
C.C6H14有多种同分异构体,其同分异构体中沸点最高的分子的一氯取代物有3种
D.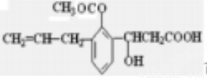 可发生取代、加成、消去、水解、氧化、加聚、缩聚反应
可发生取代、加成、消去、水解、氧化、加聚、缩聚反应
查看答案和解析>>
科目:高中化学 来源:2015届天津一中高三化学9月考化学试卷(解析版) 题型:选择题
下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的的是()
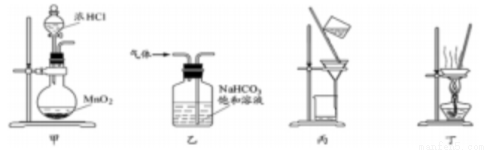
A.用装置甲制取氯气 B.用装置乙除去氯气中的少量氯化氢
C.用装置丙分离二氧化锰和氯化锰溶液 D.用装置丁蒸干氯化锰溶液制MnCl2·4H2O
查看答案和解析>>
科目:高中化学 来源:2015届四川省2015届高三9月理综化学试卷(解析版) 题型:填空题
(14分)A、B、C、D、E、F为前四周期的元素。其中,A元素和B元素的原子都有一个未成对电子,A3+比B-少一个电子层,B原子得一个电子后3p轨道全充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解性在同族元素所形成的氢化物中最大;D的最高化合价与最低化合价代数和为4,其最高价氧化物对应的水化物可以用于制取炸药和制作铅蓄电池;E元素的基态原子核外有六种运动状态的电子;F元素的单质为紫红色固体,可通过“湿法冶金”而得。请回答下列问题:
(1)CB3分子中心原子的杂化类型是 。
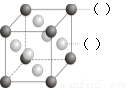
(2)F元素的原子的外围电子排布式为 ;如图所示为F与Au以3:1
形成的合金晶胞图,在图中的括号内写出对应的元素符号。B、D元素最高价
氧化物对应的水化物的酸性强弱: > (填化学式)。
(4)用导线将A和F的单质做成的电极连接起来,插入到盛有C的最高价氧化物的水化物的浓溶液中构成原电池,试写出在单质A表面发生反应的电极反应式:_____。
(5)分子R是由C元素与氢元素形成的18电子分子,R的电子式为 。
(6)24 g E的单质在33.6 L氧气(标准状况)中燃烧,至反应物全部耗尽,放出x kJ热量。则1mol E与O2反应生成E的低价氧化物时的热化学方程式为 (已知:E的燃烧热为y kJ/mol)。
查看答案和解析>>
科目:高中化学 来源:2015届四川省绵竹市高三上学期第二次月考化学试卷(解析版) 题型:实验题
(11分)海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义.
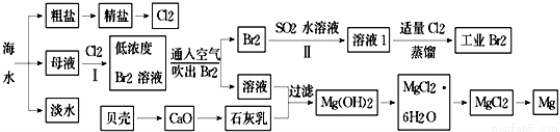
(1)氯碱工业主要以食盐为原料.为了除去粗盐中的Ca2+、Mg2+、SO42﹣及泥沙,可将粗盐溶于水,然后进行下列操作,正确的操作顺序是 .
①过滤;
②加过量的NaOH溶液;
③加适量的盐酸;
④加过量的Na2CO3溶液;
⑤加过量的BaCl2溶液.
a.②⑤④①③b.①④②⑤③c.④②⑤③①d.⑤②④①③
(2)在实验室中可以用萃取的方法提取溴,可选用的试剂是 ,所用主要仪器的名称是 .
(3)步骤Ⅰ中用硫酸酸化可提高Cl2利用率的原因是 .
(4)步骤Ⅱ反应的离子方程式 .
(5)海水提溴蒸馏过程中,温度应控制在80~90℃,温度过高或过低都不利于生产,请解释原因 .
(6)Mg(OH)2沉淀中混有Ca(OH)2,可选用 溶液进行洗涤除去.如直接加热Mg(OH)2得到MgO,再电解熔融MgO制金属镁,这样可简化实验步骤,你 (选填“同意”,“不同意”)该说法,理由是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com