
(13分)纳米氧化亚铜(Cu2O)是一种用途广泛的光电材料,常用的制备方法有电化学法、湿化学法等。电化学法可用铜棒和石墨作电极,电解Cu(NO3)2稀溶液制备。湿化学法的制备过程为:在KOH溶液中加入一定量的CuSO4溶液,再加入一定量的还原剂——肼(N2H4),加热并保持温度在90℃。检验反应完全后,分离、洗涤、真空干燥得到固体样品。反应方程式为:
4CuSO4 + N2H4 + 8KOH = 2Cu2O + N2↑+ 4K2SO4 + 6H2O
⑴电化学法制备Cu2O时,铜棒做 极,阴极生成Cu2O的电极反应式为 。
⑵湿化学法中,检验纳米Cu2O已经生成的实验方法是 。
⑶湿化学法得到的产品中常含有Cu。称取某产品1.76 g(设仅含Cu2O和Cu),加入足量的稀硝酸,充分反应后得到标准状况下的NO气体224mL,计算产品中Cu2O的质量分数。(写出计算过程)
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2013-2014学年江苏省如东县高三上学期期末四校联考化学试卷(解析版) 题型:填空题
前段时间席卷我国大部的雾霾天气给人们的生产生活带来了极大的影响,据统计我国部分城市雾霾天占全年一半,引起雾霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3、金属氧化物、有机颗粒物及扬尘等。
(1)有机颗粒物的产生主要是由于不完全燃烧导致的相关热化学方程式如下:
①C(s)+O2(g)=CO2(g) ΔH1=-94kJ·mol-1;
②C8H16(l)+12O2(g)=8CO2(g)+8H2O(l)? ΔH2=-1124kJ·mol-1
③C8H16(l)+4O2=8C(g)+8H2O(l)ΔH3=????????????????? kJ·mol-1
(2)纳米二氧化钛可光解挥发性有机污染物(VOCs),若无水蒸气存在,三氯乙烯降解反应为:C2HCl3+2O2→2CO2+HCl+Cl2,若有足够量的降解后的尾气,实验室检验产物中有氯气的简单方法是:????????????? ????????????? ????????????? ????????????? ;通过质谱仪发现还有多种副反物,其中之一为: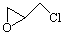 ,则该有机物核磁共振氢谱有 个峰。
,则该有机物核磁共振氢谱有 个峰。
已知:Cu(OH)2是二元弱碱;亚磷酸(H3PO3)是二元弱酸,与NaOH溶液反应,生成Na2HPO3。
(3)在铜盐溶液中Cu2+发生水解反应的离子方程式为____,该反应的平衡常数为____;(已知:25℃时,Ksp[Cu(OH)2]=2.0×10-20mol3/L3)
(4)电解Na2HPO3溶液可得到亚磷酸,装置如图(说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过)

①阳极的电极反应式为____________________。
②产品室中反应的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省招生仿真卷理科综合化学试卷(解析版) 题型:填空题
(15分)纳米级Cu2 O 粉末,由于量子尺寸效应,其具有特殊的光学、电学及光电化学性质,在太阳电池、传感器、超导体、制氢和电致变色、环境中处理有机污染物等方面有着潜在的应用。
Ⅰ.纳米氧化亚铜的制备
(1)四种制取Cu2O的方法如下:
①火法还原。用炭粉在高温条件下还原CuO;
②最新实验研究用肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时放出N2。
已知:N2H4(l)+O2(g)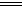 N2(g)+2H2O(l)
△H=-a
kJ/mol
N2(g)+2H2O(l)
△H=-a
kJ/mol
Cu(OH)2(s)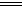 CuO(s)+H2O(l) △H=b kJ/mol
CuO(s)+H2O(l) △H=b kJ/mol
4CuO(s)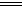 2Cu2O(s)+O2(g)
△H=c
kJ/mol
2Cu2O(s)+O2(g)
△H=c
kJ/mol
则该方法制备Cu2O的热化学方程式为 。
③工业中主要采用电解法:用铜和钛作电极,电解氯化钠和氢氧化钠的混合溶液,电解总方程式为:2Cu+H2O Cu2O+H2↑,则阳极反应式为:
。
Cu2O+H2↑,则阳极反应式为:
。
④还可采用Na2SO3还原CuSO4法:将Na2SO3 和CuSO4加入溶解槽中,制成一定浓度的溶液,通入蒸气加热,于100℃~104℃间反应即可制得。写出该反应的化学方程式: 。
Ⅱ.纳米氧化亚铜的应用
(2)用制得的Cu2O进行催化分解水的实验
①一定温度下,在2 L密闭容器中加入纳米级Cu2O并通入10. 0 mol水蒸气,发生反应:
2H2O(g)  2H2(g)+O2(g)
△H=+484 kJ·mol-1
2H2(g)+O2(g)
△H=+484 kJ·mol-1
T1温度下不同时段产生O2的量见下表:
|
时间/min |
20 |
40 |
60 |
80 |
|
n(O2)/mol |
1.0 |
1.6 |
2.0 |
2.0 |
前20 min的反应速率 v(H2O)= ;该该温度下,反应的平衡常数的表达式K= ;若T2温度下K=0.4,T1 T2(填>、<、=)
②右图表示在t1时刻达到平衡后,只改变一个条件又达到平衡的不同时段内,H2的浓度随时间变化的情况,则t1时平衡的移动方向为 ,t2时改变的条件可能为 ;若以K1、K2、K3分别表示t1时刻起改变条件的三个时间段内的平衡常数,t3时刻没有加入或减少体系中的任何物质,则K1、K2、K3的关系为 ;

③用以上四种方法制得的Cu2O在其它条件相同下分别对水催化分解,产生氢气的速率v随时间t变化如图所示。下列叙述正确的是 。

A.方法③、④制得的Cu2O催化效率相对较高
B.方法④制得的Cu2O作催化剂时,水的平衡转化率最高
C.催化效果与Cu2O颗粒的粗细、表面活性等有
D.Cu2O催化水分解时,需要适宜的温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com