
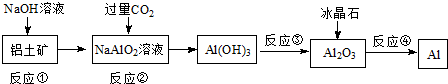
| A、流程中涉及的反应均为非氧化还原反应 |
| B、反应②产生的阴离子主要为CO32- |
| C、实验室中完成反应③应在蒸发皿中进行 |
| D、反应④的条件是电解熔融 |
| ||
| 电解 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、红热的铜丝在氯气中剧烈燃烧,生成棕黄色的烟,加少量的水形成绿色溶液 |
| B、检验氨气的方法是将湿润的蓝色石蕊试纸靠近瓶口或管口,观察试纸是否呈红色 |
| C、在淀粉溶液中加入稀硫酸并加热数分钟,冷却后依次加入新制Cu(OH)2悬浊液和碘水可检验淀粉是否已发生水解和是否完全水解 |
| D、铁钉放试管中,加入2mL水、3滴稀醋酸和1滴K3[Fe(CN)6]溶液,不久铁钉周围出现蓝色溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
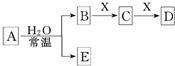 由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去),下列推断不正确的是( )
由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去),下列推断不正确的是( )| A、若D为白色沉淀,与A摩尔质量相等,则X一定是铝盐 |
| B、若D为CO,C能和E反应,则A是Na2O2,X的同素异形体只有3种 |
| C、若A是单质,B和D的反应是OH-+HCO3-=H2O+CO32-,则E一定能还原Fe2O3 |
| D、若X是Na2SO3,C为气体,则A可能是氯气,且D和E能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下溶解度:Na2CO3<NaHCO3 |
| B、热稳定性:Na2CO3<NaHCO3 |
| C、与同浓度同体积的盐酸反应的速率:Na2CO3>NaHCO3 |
| D、与澄清石灰水反应,均有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应体现了浓硫酸的酸性和强氧化性 | ||
| B、应体结束后两两种反应物均有剩余 | ||
C、被还原的硫酸为
| ||
| D、参加反应的Cu为0.9 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
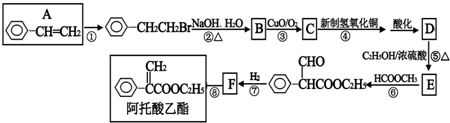
| A、取代,4 mol Cl2 |
| B、加成,2mol Cl2 |
| C、加成,取代,3 mol Cl2 |
| D、加成,消去,取代,3 mol Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
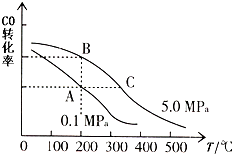 (1)在电化学中,常用碳作电极:
(1)在电化学中,常用碳作电极:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com