
| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 21.98 | 20.00 |
| 2 | 0.10 | 22.00 | 20.00 |
| 3 | 0.10 | 22.02 | 20.00 |
| c(标准)×V(标准) |
| V(待测) |
| 21.98+22.00+22.02 |
| 3 |
| 22.00×10-3L×0.10mol/L |
| 0.020L |
| 0.02×10-3L×0.10mol/L |
| 0.04L |
| 10-14 |
| 5×10-5 |
| c(标准)×V(标准) |
| V(待测) |


科目:高中化学 来源: 题型:
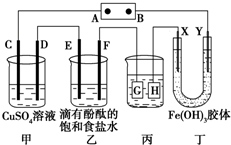 如图所示装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中的溶液都是1mol?L-1 500mL(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.请回答:
如图所示装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中的溶液都是1mol?L-1 500mL(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
 对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的.如图为一“链状连环”图案,图案上由左到右分别写了H2、CO2、Na2O、NaCl、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分由左到右A、B、C、D为其相应的分类依据代号.
对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的.如图为一“链状连环”图案,图案上由左到右分别写了H2、CO2、Na2O、NaCl、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分由左到右A、B、C、D为其相应的分类依据代号.查看答案和解析>>
科目:高中化学 来源: 题型:
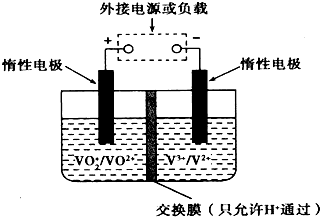 钒(V)及其化合物广泛应用于工业催化,新材料和心能源等领域.
钒(V)及其化合物广泛应用于工业催化,新材料和心能源等领域.查看答案和解析>>
科目:高中化学 来源: 题型:
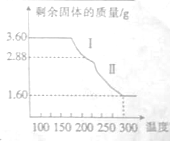 铁及铁的化合物用途非常广泛.
铁及铁的化合物用途非常广泛.查看答案和解析>>
科目:高中化学 来源: 题型:
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.50 | 25.40 |
| 第二次 | 20.00 | 4.00 | 29.10 |
| 第三次 | 20.00 | 3.50 | 26.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:
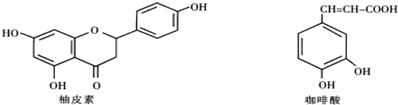
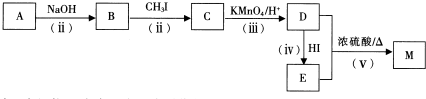

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2O2的氧化性比Fe3+强,其还原性比Fe2+强 |
| B、在H2O2分解过程中,Fe2+和Fe3+的总量保持不变 |
| C、在H2O2分解过程中,溶液的pH逐渐下降 |
| D、H2O2生产过程要严格避免混入Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com