
下列说法正确的是( )。
A.所有的不锈钢都只含有金属元素
B.我国流通的硬币材质是金属单质
C.广东打捞出的明代沉船上存在大量铝制餐具
D.镁合金的硬度和强度均高于纯镁
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列说法不正确的是
| A. | B. | C. | D. |
| 通电一段时间后,搅拌均匀,溶液的pH增大 | 甲电极上的电极反应为: 2Cl- -2e- = Cl2↑ | Pt电极上的电极反应为:O2+2H2O+4e-==4OH- | 总反应的离子方程式为: 2Fe3++Cu=Cu2++ 2Fe2+ |
|
|
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭体系中发生下列反应A(g)+3B(g) 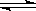 2C(g) △H<0,下图是某一时间段中反应速率与反应进程的曲线关系,完成下列问题:
2C(g) △H<0,下图是某一时间段中反应速率与反应进程的曲线关系,完成下列问题:
(1)t1、t3、t4时刻体系中所改变的条件可能是:
__________、__________、__________;
(2)C体积分数最高的时间段是__________。(填“tx-ty”)
【知识点】平衡的移动

查看答案和解析>>
科目:高中化学 来源: 题型:
下表是某地市场销售的一种“加碘食盐”包装袋上的部分文字说明。
| 配 料 | 氯化钠、碘酸钾 |
| 含碘量 | (20mg~40mg)/1kg |
| 保质期 | 18个月 |
| 食用方法 | 勿长时间炖炒 |
| 贮藏指南 | 避热、防潮 |
(1)已知碘在碘酸钾中的化合价为+5,1mol碘酸钾中共含5mol原子,则碘酸钾的化学式为 。
(2)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式:
____ + KI+ H2SO4— K2SO4+ I2+ H2O
(3)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。某学生设计回收四氯化碳的操作步骤为:
a. 将碘的四氯化碳溶液置于分液漏斗中;
b. 加入适量Na2SO3稀溶液;
c. 分离出下层液体。
以上设计中遗漏的操作及在上述步骤中的位置是 。
(4)由食用方法和贮藏指南可推测碘酸钾的化学性质之一是 。
(5)用单质碘与氯酸钾发生置换反应可制得碘酸钾,该反应的化学方程式
为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示是向MgCl2和AlCl3的混合溶液中加入NaOH溶液和盐酸时沉淀的物质的量y mol与加入NaOH溶液和盐酸的体积x mL的关系图,根据图示判断,下列结论中不正确的是( )
A.N点时溶液中的溶质只有NaCl
B.原混合溶液中c (MgCl2)∶c (AlCl3)=1∶2
C.c (NaOH)=c (HCl)
D.M点之前加入的是NaOH溶液,M点之后加入的是盐酸

查看答案和解析>>
科目:高中化学 来源: 题型:
设NA 为阿伏加德罗常数的值。下列说法正确的是
A.1 L 0.1mol•L-1的氨水含有0.1NA个OH-
B.1 L 1 mol·L-1的NaClO溶液中含有ClO-的数目为NA
C.25℃时,pH =13的Ba(OH)2溶液中含有OH-的数目为0 .1 NA
D.在电解精炼粗铜的过程中,当阴极析出32 g铜时转移电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在1×lO5 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是
A. H2O(g)=H2(g)+ 1/2O2 (g)△H=+242 kJ.mol-1 B. 2H2(g)+O2(g)=2H2O(l) △H= -484 kJ.mol-l
C. H2(g)+ 1/2O2(g)=H2O(g) △H=+242 kJ.mol-l D. 2H2(g) + O2(g) = 2 H2O(g) △H= -484 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com