
【题目】氢气、碳氧化物是合成可再生能源甲醇的基础原料,具有重要的应用前景。
(1)已知H2(g)、CO(g)和CH4(g)的燃烧热分别为285.8 kJ·mol-1、283.0 kJ·mol-1和890.0 kJ·mol-1。一定条件下,CO与H2合成甲烷的热化学方程式为:CO(g)+3H2(g)==CH4(g)+H2O(1)△H
则△H=________;该反应能自发进行的原因是_____________________________________。
(2)工业上一般采用下列两种反应合成甲醇:
反应I:CO(g)+2H2(g) ![]() CH3OH(g)
CH3OH(g)
反应II:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
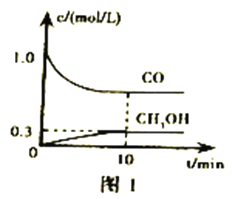
①一定温度下,在体积可变的恒压密闭容器中加入4molH2和一定量的CO发生反应I,开始时容器体积为2L,CO和CH3OH(g)的浓度随时间变化如图1。10min达到平衡,则反应I的化学平衡常数为______________(结果保留一位小数)。
②恒温恒容条件下,在密闭容器中通入等物质的量的CO2和H2,下列描述能说明反应II已经达到平衡状态的是________________(填序号)。
A.容器内CO2的体积分数不再变化 B.当CO2和H2转化率的比值不再变化
C.当水分子中断裂2NA个O-H键,同时氢分子中断裂3NA个H-H键
D.容器内混合气体的平均相对分子质量达到34.5,且保持不变
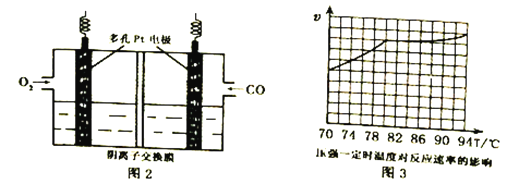
(3)用KOH作电解质的CO碱性燃料电池(如图2)作电源,用惰性电极电解含CN-废水,将CN-彻底氧化为无害气体,以净化废水。该电池的负极反应式为_____________;若开始时正、负两电极区溶液质量相等,当除去1molCN-时,理论上两电极区溶液的质量差为______g。
(4)工业上通过CO与甲醇制取甲酸甲酯,热化学方程式为:CO(g)+ CH3OH(g) ![]() HCOOCH3(g)△H =-29kJ·mol-1 。科研人员对该反应进行了研究,部分研究结果如图3。实际工业生产中采用的温度是80℃,其理由是__________________________。
HCOOCH3(g)△H =-29kJ·mol-1 。科研人员对该反应进行了研究,部分研究结果如图3。实际工业生产中采用的温度是80℃,其理由是__________________________。
【答案】 -250.4 kJ·mol-1 该反应焓变数值较大,且小于0 0.1 C CO+4OH--2e-═CO32-+2H2O 200 高于80℃,温度对反应速率影响较小;且反应放热,升温平衡逆向移动,转化率降低
【解析】试题分析:(1)根据盖斯定律计算CO(g)+3H2(g)==CH4(g)+H2O(1)的△H;根据焓判据,化学反应易向放热方向进行;(2)①开始时容器体积是2L,CO浓度是1mol/L,则CO的物质的量是2mol,设反应消耗CO的物质的量为xmol,平衡后容器体积为vL, 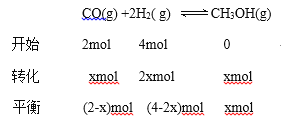
![]() ,得
,得![]() ;根据
;根据![]() 计算平衡常数;②根据平衡标志分析;(3)用KOH作电解质的CO碱性燃料电池,通入CO的电极是负极,CO失电子发生氧化反应生成CO32-;除去1molCN-时转移电子5mol,根据电子守恒,正极需通入1.25mol氧气,负极通入2.5molCO,5molOH-从阴离子交换膜的左侧移动到右侧;(4)高于80℃,温度对反应速率影响较小;且CO(g)+ CH3OH(g)
计算平衡常数;②根据平衡标志分析;(3)用KOH作电解质的CO碱性燃料电池,通入CO的电极是负极,CO失电子发生氧化反应生成CO32-;除去1molCN-时转移电子5mol,根据电子守恒,正极需通入1.25mol氧气,负极通入2.5molCO,5molOH-从阴离子交换膜的左侧移动到右侧;(4)高于80℃,温度对反应速率影响较小;且CO(g)+ CH3OH(g) ![]() HCOOCH3(g)反应放热,升温平衡逆向移动,转化率降低。
HCOOCH3(g)反应放热,升温平衡逆向移动,转化率降低。
解析:H2(g)、CO(g)和CH4(g)的燃烧热分别为285.8 kJ·mol-1、283.0 kJ·mol-1和890.0 kJ·mol-1,则①2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1;②2CO(g)+O2(g)=2CO2(g) ΔH=-566.0 kJ·mol-1;③CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) ΔH = -890 kJ·mol-1,根据盖斯定律②![]() +①
+①![]() -③得 CO(g)+3H2(g)==CH4(g)+H2O(1)△H=-250.4 kJ·mol-1;根据焓判据,该反应焓变数值较大,且小于0,所以该反应能自发进行。(2)①开始时容器体积是2L,CO浓度是1mol/L,则CO的物质的量是2mol,设反应消耗CO的物质的量为xmol,平衡后容器体积为vL,
-③得 CO(g)+3H2(g)==CH4(g)+H2O(1)△H=-250.4 kJ·mol-1;根据焓判据,该反应焓变数值较大,且小于0,所以该反应能自发进行。(2)①开始时容器体积是2L,CO浓度是1mol/L,则CO的物质的量是2mol,设反应消耗CO的物质的量为xmol,平衡后容器体积为vL, 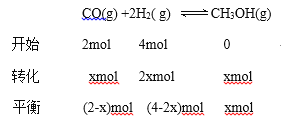
![]() ,得
,得![]() ;
; ![]() =
=![]() 0.1 ;②
0.1 ;②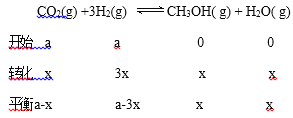 ,
,
容器内CO2的体积分数=![]() ,容器内CO2的体积分数是定值,所以CO2的体积分数不再变化,不一定达到平衡状态,故A错误; CO2和H2转化率的比值=
,容器内CO2的体积分数是定值,所以CO2的体积分数不再变化,不一定达到平衡状态,故A错误; CO2和H2转化率的比值=![]() , CO2和H2转化率的比值是定值,所以CO2和H2转化率的比值不再变化,不一定平衡,故B错误;当水分子中裂2NA个O-H键,同时氢分子中断裂3NA个H-H键,说明正逆反应速率相等,一定达到平衡状态,故C正确;容器内混合气体的平均相对分子质量不可能达到34.5,故D错误。 (3)用KOH作电解质的CO碱性燃料电池,通入CO的电极是负极,CO失电子发生氧化反应生成CO32-,负极反应式是CO+4OH--2e-═CO32-+2H2O;除去1molCN-时转移电子5mol,根据电子守恒,正极需通入1.25mol氧气,负极通入2.5molCO,5molOH-从阴离子交换膜的左侧移动到右侧;所以左侧质量减少
, CO2和H2转化率的比值是定值,所以CO2和H2转化率的比值不再变化,不一定平衡,故B错误;当水分子中裂2NA个O-H键,同时氢分子中断裂3NA个H-H键,说明正逆反应速率相等,一定达到平衡状态,故C正确;容器内混合气体的平均相对分子质量不可能达到34.5,故D错误。 (3)用KOH作电解质的CO碱性燃料电池,通入CO的电极是负极,CO失电子发生氧化反应生成CO32-,负极反应式是CO+4OH--2e-═CO32-+2H2O;除去1molCN-时转移电子5mol,根据电子守恒,正极需通入1.25mol氧气,负极通入2.5molCO,5molOH-从阴离子交换膜的左侧移动到右侧;所以左侧质量减少![]() ,右侧质量增加
,右侧质量增加![]() ,理论上两电极区溶液的质量差为200g。(4)高于80℃,温度对反应速率影响较小;且CO(g)+ CH3OH(g)
,理论上两电极区溶液的质量差为200g。(4)高于80℃,温度对反应速率影响较小;且CO(g)+ CH3OH(g) ![]() HCOOCH3(g)反应放热,升温平衡逆向移动,转化率降低,所以工业生产中采用的温度是80℃。
HCOOCH3(g)反应放热,升温平衡逆向移动,转化率降低,所以工业生产中采用的温度是80℃。


科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1mol·L-1,体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,且保持Va+Vb=100mL,Va、Vb与混合液的pH的关系如图所示.下列说法正确的是
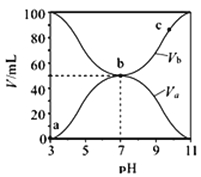
A. Ka(HA)≈1×10-6
B. c点时, 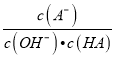 随温度升高而增大
随温度升高而增大
C. a→c过程中水的电离程度始终增大
D. b点时,c(B+)=c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.01mol·L-1 的醋酸溶液中逐渐加入冰醋酸至1mol·L-1,随着浓度的增加,在一定时间内始终保持减小趋势的是
A. c(H+) B. c(CH3COO-)
C. c(H+)/c(CH3COOH)的比值 D. c(CH3COOH)/c(H+)的比值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应完毕后有沉淀的是( )
A.BaCl2溶液与Na2CO3溶液加足量稀醋酸
B.Ba(OH)2溶液与KNO3溶液加足量H2SO4
C.AgNO3溶液与Na2CO3溶液加足量稀硝酸
D.Ca(OH)2溶液与FeCl3溶液加足量稀硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于NH4Cl的化学用语正确的是
A. 氯离子的结构示意图: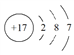
B. 其溶液呈酸性的原因:NH4Cl + H2O NH3·H2O +HCl
C. 工业上“氮的固定”:NH3 + HCl = NH4Cl
D. 比较微粒半径:N>Cl->H
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2广泛用于医药、硫酸工业等领域,回收废气中的SO2可用如下方法。
方法Ⅰ | 用碱式硫酸铝Al2(SO4)x(OH)y溶液吸收富集SO2 |
方法Ⅱ | 在Fe2+或Fe3+催化下,用空气(O2)将SO2氧化为H2SO4 |
(1)方法Ⅰ的过程如下。
① 制备Al2(SO4)x(OH)y
向Al2(SO4)3溶液中加入CaO粉末,调pH至3.6。 CaO的作用之一是促进_______水解(填离子符号,下同),二是沉淀一部分_______。
② 吸收:Al2(SO4)x(OH)y吸收SO2后的产物是_______(写化学式)。
③ 解吸:加热②中产物,产生SO2,Al2(SO4)x(OH)y再生。
(2)方法Ⅱ中,在Fe2+催化下,SO2、O2和H2O生成H2SO4的化学方程式是______。
(3)方法Ⅱ中,Fe2+的催化过程可表示如下:
ⅰ:2 Fe2++ SO2+ O2=2 Fe3++ SO42-
ⅱ: ……
① 写出ⅱ的离子方程式:______。
② 下列实验方案可证实上述催化过程。将实验方案补充完整。
a.向FeCl2溶液滴入KSCN,无变化
b.向FeCl2溶液通入少量SO2,滴入KSCN,颜色变红。
c.取b中溶液,_______。
(4)方法Ⅱ中,催化氧化后,采用滴定法测定废气中残留SO2的含量。将V L(已换算为标准状况)废气中的SO2用1%的H2O2完全吸收,吸收液用下图所示装置滴定,共消耗a mL c mol/L NaOH标准液。

① H2O2氧化SO2的化学方程式_______。
② 废气中残留SO2的体积分数为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知t℃时AgCl的溶度积Ksp=4×10-10,在t℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。请回答下列问题:
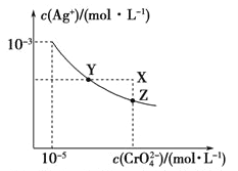
(1)Ag2CrO4沉淀溶解平衡的Ksp表达式为____________________________;
(2)①向Ag2CrO4沉淀中滴加氯化钠溶液,可见到红色沉淀慢慢转变为白色沉淀,写出沉淀转化的离子方程式______________________________________________________;
②该沉淀转化反应平衡常数的值为_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com