
| A、NaHA的电离方程式:═Na++H++A2- |
| B、HA-的水解方程式:HA-+H2O?H3O++A2- |
| C、该溶液中离子的物质的量浓度关系:c(Na+)>c(HA-)>c(OH-)>c(H+)>c(A2-) |
| D、该溶液中离子的物质的量浓度关系:c(Na+)+c(H+)=c(OH-)+c(A2-)+c(HA-) |


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
| A、石油裂解、煤的气化、海水制镁、纤维素制火棉等过程中都包含化学变化 |
| B、红宝石、水晶、玻璃、陶瓷等都是硅酸盐制品 |
| C、光导纤维、醋酸纤维、铜氨纤维、玻璃纤维等的主要成分都是糖类 |
| D、PM2.5是指大气中直径小于或等于2.5纳米的颗粒物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol CO2的体积约是22.4L |
| B、1mol氦气中含有2NA个原子 |
| C、0.3molN2、0.7molO2的混合气体在标准状况下的体积约为22.4L |
| D、1mol H2SO4所含粒子数为NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe、Mg |
| B、Zn、Al |
| C、Zn、Ag |
| D、Cu、Al |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在制取干燥纯净的氯气时,先使氯气通过饱和食盐水,后通过浓硫酸 |
| B、准确量取25.00mL高锰酸钾溶液,可选用50mL量筒 |
| C、测定中和热时,为了减少热量损失,不要搅拌溶液 |
| D、分离乙醇和乙酸乙酯的混合物用到的玻璃仪器是分液漏斗和烧杯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若n=2,则分子的立体结构为V形 |
| B、若n=3,则分子的立体结构为三角锥形 |
| C、若n=4,则分子的立体结构为正四面体形 |
| D、以上说法都不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
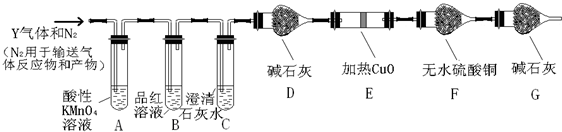
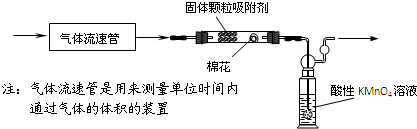
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 待提纯物质 | 杂质 | 除杂试剂及主要操作方法 |
| A | 苯 | 溴单质 | 加亚硫酸钠溶液洗涤,分液 |
| B | 淀粉 | 葡萄糖 | 水,过滤 |
| C | 甲烷 | 乙烯 | 通入酸性高锰酸钾溶液,洗气 |
| D | 乙酸乙酯 | 乙酸 | 加入氢氧化钠溶液,分液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②④ | B、①②④⑤ |
| C、②④⑤⑥ | D、②⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com