

分析 (1)Cl的最高价氧化物为Cl2O7,与水反应生成HClO4,以此书写热化学方程式;
(2)根据盖斯定律由已知的热化学方程式乘以相应的数值进行加减,来构造目标热化学方程式,反应热也乘以相应的数值进行加减,据此判断;
(3)根据化学键断裂要吸收热量,形成化学键要放出热量,1molN4气体中含有6molN-N键,可生成2molN2,形成2molN≡N键,则1molN4气体转变为N2化学键断裂断裂吸收的热量为6×167KJ=1002KJ,形成化学键放出的热量为1884KJ,所以反应放热,放出的热量为1884KJ-1002KJ=882KJ;
(4)根据生成1mol水放出的热量计算反应热,生成1mol水时,二甲醚燃烧放出485KJ的热量,则生成3mol水,放出的热量为3×485KJ=1455KJ,结合热化学方程式书写方法写出.
解答 解:(1)Cl的最高价氧化物为Cl2O7,与水反应生成HClO4,反应的化学方程式为Cl2O7+H2O=2HClO4,0.25mol时放出的热量为QkJ,则1mol反应放出4QKJ的热量,反应的热化学方程式为Cl2O7(l)+H2O(l)=2HClO4(aq)△H=-4QkJmol-1,
故答案为:Cl2O7(l)+H2O(l)=2HClO4(aq)△H=-4QkJmol-1;
(2):①Fe2O3(s)+$\frac{3}{2}$C(s)═$\frac{3}{2}$CO2(g)+2Fe(s)△H=+234.1kJ/mol
②C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
由盖斯定律②×$\frac{3}{2}$-①得:2Fe(s)+$\frac{3}{2}$O2(g)=Fe2O3(s)△H=(-393.5kJ•mol-1)×$\frac{3}{2}$-234.1kJ•mol-1
即2Fe(s)+$\frac{3}{2}$O2(g)=Fe2O3(s)△H=-824.4kJ•mol-1,故答案为:-824.4;
(3)1molN4气体中含有6molN-N键,可生成2molN2,形成2molN≡N键,则1molN4气体转变为N2化学键断裂断裂吸收的热量为6×167KJ=1002KJ,形成化学键放出的热量为1884KJ,所以反应放热,放出的热量为1884KJ-1002KJ=882KJ,故应为放出882KJ热量,则1molN4气体转变为N2的热化学方程式:
N4 (g)=2N2(g)△H=-882KJ/mol,
故答案为:N4 (g)=2N2(g)△H=-882KJ/mol;
(4)由图象可知生成1mol水时,二甲醚燃烧放出485KJ的热量,则生成3mol水,放出的热量为3×485KJ=1455KJ,
所以热化学方程式为CH3OCH3(g)+3O2(g)$\stackrel{点燃}{→}$2CO2(g)+3H2O(l)△H=-1455kJ•mol-1,
故答案为:CH3OCH3(g)+3O2(g)$\stackrel{点燃}{→}$2CO2(g)+3H2O(l)△H=-1455kJ•mol-1.
点评 本题考查了热化学方程式书写方法,反应焓变的计算应用,图象分析判断,掌握基础是解题关键,题目较简单.


科目:高中化学 来源: 题型:填空题
 ,它是由极性共价键形成的极性分子.
,它是由极性共价键形成的极性分子. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.25mol | B. | 0.5mol | C. | 1mol | D. | 2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用药匙取用粉末状或小颗粒状固体 | |
| B. | 用胶头滴管滴加少量液体 | |
| C. | 给盛有2/3体积液体的试管加热 | |
| D. | 过滤时漏斗的下端管口要紧靠烧杯内壁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氯化钡溶液可区别SO42-和CO32-离子 | |
| B. | 只能用加入试剂的方法区别(NH4)2 SO4和Fe2(SO4)3溶液 | |
| C. | 用丁达尔效应可区别Fe(OH)3胶体和饱和FeCl3溶液 | |
| D. | 用澄清石灰水可区别Na2CO3溶液和NaHCO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V1=10V2 | B. | V1>10V2 | C. | V1<10V2 | D. | V2>10V1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 人工肾脏可用间接电化学方法除去代谢产物中的尿素(CO(NH2)2),原理如图.
人工肾脏可用间接电化学方法除去代谢产物中的尿素(CO(NH2)2),原理如图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
| 含氧酸 |  | 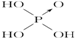 |  |  |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
 ,亚砷酸
,亚砷酸 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com