
【题目】硫代硫酸钠(Na2S2O3)可以除去自来水中的氯气,在水产养殖上被广泛应用。用纯碱和硫化碱(主要成分Na2S,含少量Na2SO4、Na2CO3等)为原料制备Na2S2O3·5H2O的实验流程如下:

回答下列问题:
(1)试剂X是一种二元化合物的钡盐,它与Na2SO4反应的化学方程式为___________________。
(2)用热水溶解并趁热过滤的目的是______________________。
(3)利用SO2与Na2CO3、Na2S的混合溶液反应制备Na2S2O3,所需仪器如下图:
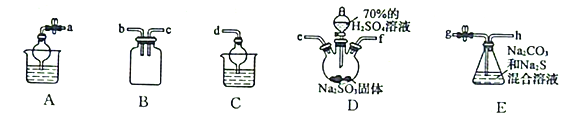
①从左到右连接各仪器,导管的接口顺序为:___________接e、f接___________、___________接___________、___________接d。___________
②E中发生反应的离子方程式为______________________。
③装置B的作用是______________________。
(4)操作1包括蒸发浓缩、______________________、___________、洗涤、干燥
(5)为测定产品Na2S2O3·5H2O的纯度,准确称取12.4gNa2S2O3·5H2O产品,配制成100mL溶液,取25.00mL溶液,以淀粉溶液作指示剂,用0.2500mol·L-1碘的标准溶液滴定,发生反应2S2O32-+I2= S4O62-+2I-,消耗碘的标准溶液20.00mL,则该产品的纯度为___________。
【答案】BaS+Na2SO4= BaSO4+Na2S 更快更多溶解硫化碱,并防止过滤时,因降温而析出Na2S,造成损失 a b c g h CO32-+2 S2-+SO2=3S2O32-+CO2 作安全瓶,防止E中溶液倒吸入D中 冷却结晶 过滤 80%
【解析】
用纯碱和硫化碱(主要成分Na2S,含少量Na2SO4、Na2CO3等)为原料制备Na2S2O3·5H2O,根据实验流程,用热水溶解硫化碱可以更快更多溶解硫化碱,然后加入试剂X,试剂X是一种二元化合物的钡盐,为了不引入新杂质,所以可考虑使用BaS,反应生成硫酸钡、碳酸钡沉淀,过滤除去,然后在滤液中通入二氧化硫,并加入碳酸钠,硫化钠与二氧化硫、碳酸钠反应生成硫代硫酸钠,蒸发浓缩,冷却结晶得到Na2S2O3·5H2O,据此分析解答。
(1)该实验流程的目的是用硫化碱(主要成分Na2S,含少量Na2SO4、Na2CO3等)制备Na2S2O35H2O,原料中含杂质Na2SO4、Na2CO3等,净化时考虑除去SO42-,CO32-,试剂X是一种二元化合物的钡盐,为了不引入新杂质,所以可考虑使用BaS,因此与Na2SO4反应的化学方程式为BaS+Na2SO4= BaSO4↓+Na2S,故答案为:BaS+Na2SO4= BaSO4↓+Na2S;
(2)用热水溶解可以更快更多溶解硫化碱,趁热过滤可以防止过滤时,因降温而析出Na2S,造成损失,故答案为:更快更多溶解硫化碱,并防止过滤时,因降温而析出Na2S,造成损失;
(3)①利用SO2与Na2CO3、Na2S的混合溶液反应制备Na2S2O3,反应的方程式为Na2CO3+2Na2S+4SO2=3Na2S2O3+CO2,根据提供的装置图,D为二氧化硫的发生装置,E为三者的反应装置,尾气中的二氧化硫需要吸收,并防止倒吸,用C装置处理,需按下列顺序连接装置,A(实验后期关闭E中止水夹,打开A中止水夹,可吸收多余SO2)→D(制取SO2)→B(安全装置)→E(制取Na2S2O3)→C(吸收SO2尾气),所以各接口的顺序为: a接e、f接b、c接g、h接d,故答案为:a b c g h;
②E中发生反应的离子方程式为CO32-+2 S2-+SO2=3S2O32-+CO2,故答案为:CO32-+2 S2-+SO2=3S2O32-+CO2;
③装置B是安全瓶,防止E中溶液倒吸入D中,故答案为:作安全瓶,防止E中溶液倒吸入D中;
(4) 硫化钠与二氧化硫、碳酸钠反应生成硫代硫酸钠,要得到硫代硫酸钠晶体,可以蒸发浓缩,冷却结晶得到Na2S2O3·5H2O,因此操作1包括蒸发浓缩、冷却结晶,过滤、洗涤、干燥,最终得到Na2S2O3·5H2O,故答案为:冷却结晶;过滤;
(5) 20.00mL 0.2500mol·L-1碘的标准溶液中含有碘的物质的量为0.02L×0.2500mol/L=0.005mol,根据2S2O32-+I2= S4O62-+2I-,样品中含有的Na2S2O3·5H2O为0.005mol×2×![]() =0.04mol,因此样品中含有的Na2S2O3·5H2O的纯度为
=0.04mol,因此样品中含有的Na2S2O3·5H2O的纯度为![]() ×100%=80%,故答案为:80%。
×100%=80%,故答案为:80%。


科目:高中化学 来源: 题型:
【题目】现有前四周期T、X、Y、Z、W、M六种元素,已知W、Z、X、T、Y五种非金属元素原子半径依次减小,其中W原子的s电子总数等于p电子总数的2倍,M原子的M能层上有4个未成对电子。请回答下列问题:
(1)写出W、Z、X、T四种元素第一电离能由大到小的顺序:____________(用元素符号表示)。
(2)基态M原子的核外电子排布式为__________________________。
(3)根据VSEPR理论,推断出由W与X两元素组成的最简单二价阴离子的立体构型为____________,W原子的杂化类型为____________。
(4)Y与T、X、Z、W所形成的最简单化合物的沸点由高到低的顺序为__________________________(用化学式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锗是第四周期第ⅣA族元素,锗是重要的半导体材料,用于制造晶体管及各种电子装置。下图为以锗锌矿(含GeO2、ZnS及少量Fe2O3)为原料生产高纯度锗的工艺流程如下:
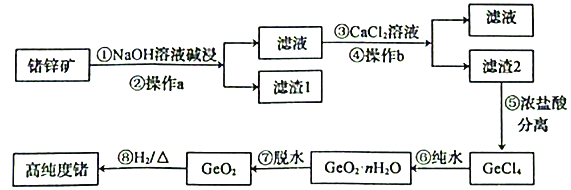
已知:GeO2可溶于强碱溶液,生成锗酸盐。GeCl4的熔点为-49.5℃,沸点为84℃,在水中或酸的稀溶液中易水解。
回答下列问题:
(1)步骤①中提高碱浸效率的措施有______________________(写一种),NaOH溶液碱浸时发生反应的离子方程式为______________________。
(2)操作a的名称是___________,GeCl4的电子式为_______________。
(3)滤渣1中除含有ZnS外,还含有少量___________。滤渣2中除含有 CaGeO3外,还含有少量___________。
(4)步骤⑤中加入浓盐酸,发生反应的化学方程式为______________________。不用稀盐酸的原因是______________________。
(5)写出一种证明步骤⑧反应完全的操作方法:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g) ![]() 4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,下列说法正确的是
4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,下列说法正确的是
A.该反应的化学平衡常数表达式是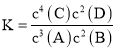
B.增加B,平衡向右移动,B的平衡转化率增大
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.此时,B的平衡转化率是40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯,反应装置如图。下列对该实验的叙述错误的是
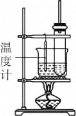
A.长玻璃管起冷凝回流作用
B.水浴加热其优点是受热均匀,便于控制温度
C.粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后再用蒸馏水洗涤
D.洗涤后,用无水CaCl2干燥,然后过滤,得到纯硝基苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)写出FeCl3水解反应的离子方程式_________。
(2)写出草酸使酸性高锰酸钾溶液褪色反应的离子方程式______。
(3)通常状况1mol葡萄糖(C6H12O6)完全氧化可放出2804kJ的热量,写出葡萄糖燃烧热的热化学方程式_____。
(4)泡沫灭火器中所用试剂为硫酸铝溶液和碳酸氢钠溶液,请写出灭火时两溶液混合反应的化学方程式_____。
(5)H3PO2是一种化工产品。
①H3PO2为一元中强酸,写出其电离方程式:_________。
②NaH2PO2为____(填“正盐”或“酸式盐”),其溶液显____(填“弱酸性”、“中性”或“弱碱性”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应由两步反应A→B、B→C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能)。下列有关叙述正确的是
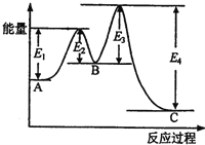
A. 两步反应均为吸热反应 B. 三种化合物中C最稳定
C. 加入催化剂会改变反应的焓变 D. 整个反应的ΔH=E1-E2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成,回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过_______方法区分晶体、准晶体和非晶体。
(2)基态铜原子的电子排布式为_______。
(3)CuO在高温时分解为O2和Cu2O,请从阳离子的结构来说明在高温时,Cu2O比CuO更稳定的原因是_______。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有_______个铜原子。
(4)Cu2+能与乙二胺(H2N—CH2—CH2—NH2)形成配离子如图:![]() ,该配离子中含有的化学键类型有______(填字母序号)。
,该配离子中含有的化学键类型有______(填字母序号)。
A.配位键 B.极性键 C.离子键 D.非极性键
(5)羰基铁[Fe(CO)5]可用作催化剂、汽油抗暴剂等。1molFe(CO)5分子中含____molσ键,与CO互为等电子体的离子是__(填化学式,写一种)。
(6)某种磁性氮化铁的结构如图所示,N随机排列在Fe构成的正四面体空隙中。正六棱柱底边长为acm,高为ccm,阿伏加德罗常数的值为NA,则该磁性氮化铁的晶体密度为____g/cm3(列出计算式)。
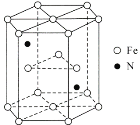
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关,下列说法不正确的是![]()
A.酸雨样品露天放置一段时间,酸性增强,是因为发生了氧化还原反应
B.纳米铁粉可将地下水中的![]() 转化为
转化为![]() ,是因为纳米铁粉具有还原性
,是因为纳米铁粉具有还原性
C.将草木灰与![]() 混合施用,可更好为植物全面提供N、P、K三种营养元素
混合施用,可更好为植物全面提供N、P、K三种营养元素
D.生活中常用可溶性铝盐净水,可加速水中悬浮物沉降
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com