
| A. | 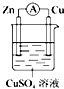 | B. |  | C. | 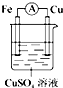 | D. |  |
分析 如果下列装置中电流表中没有电流产生,说明不能构成原电池;根据原电池的构成条件分析,原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应.
解答 解:A、该装置锌置换出铜,符合原电池的构成条件,所以能构成原电池,故A正确;
B、该装置锌置换出氢气,符合原电池的构成条件,所以能构成原电池,故B正确;
C、该装置铁置换出铜,符合原电池的构成条件,所以能构成原电池,故C正确;
D、铜和稀硫酸不能自发的发生氧化还原反应,所以不能构成原电池,故D错误.
故选D.
点评 本题考查了原电池的构成条件,难度不大,注意:这几个条件必须同时共存才能构成原电池,缺一不可.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 硅是人类将太阳能转换为电能的常用材料 | |
| B. | 粗硅制备单晶硅不涉及氧化还原反应 | |
| C. | 反应:Si+2NaOH+H2O═Na2SiO3+2H2↑中,Si为还原剂,NaOH和H2O为氧化剂 | |
| D. | 硅能与氢氟酸反应,则硅可以与盐酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑥ | B. | ②⑤ | C. | ①③④ | D. | ②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝溶于氢氧化钠溶液:Al+2OH-+H2O═AlO2-+2H2↑ | |
| B. | 铜片投入少量FeCl3溶液中:3Cu+2Fe3+═2Fe+3Cu2+ | |
| C. | Ca(HCO3)2溶液与足量澄清石灰水混合:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| D. | 用铁棒作电极电解CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu↓+O2↑+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的 |
| A | 向醋酸溶液中加入少量石灰石固体 | 验证醋酸与碳酸的酸性强弱 |
| B | 在淀粉溶液中加入20%的稀H2SO4水解后,立即加入银氨溶液做银镜反应实验 | 验证淀粉水解是否有葡萄糖生成 |
| C | 在CuSO4溶液中加入过量NaOH溶液振荡,立即加入某同学尿液并加热 | 验证该同学是否患有糖尿病 |
| D | 在乙醇溶液中插入一根灼热变黑的铜丝 | 验证乙醇是否被氧化成醛 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 A(g)+3B(g)?2C(g)反应在密闭容器中进行,若保持容积不变,在温度分别为T1和T2时,达到平衡,B的体积分数与时间的关系如图所示,现象一体积可变的密闭容器中通入等物质的量的A气体和B气体,在恒温条件下发生反应发到平衡状态Ⅰ后,再升高温度,继续反应一段时间后达到平衡状态Ⅱ.下列叙述中正确的是( )
A(g)+3B(g)?2C(g)反应在密闭容器中进行,若保持容积不变,在温度分别为T1和T2时,达到平衡,B的体积分数与时间的关系如图所示,现象一体积可变的密闭容器中通入等物质的量的A气体和B气体,在恒温条件下发生反应发到平衡状态Ⅰ后,再升高温度,继续反应一段时间后达到平衡状态Ⅱ.下列叙述中正确的是( )| A. | T1>T2,该反应生成物的总能量高于反应物的总能量 | |
| B. | 该反应在高温时才能自发进行 | |
| C. | 由平衡状态Ⅰ到平衡状态Ⅱ的过程中,平衡向逆向移动,A的体积分数一直没有变化 | |
| D. | 反映从开始到平衡状态Ⅱ的过程中,平衡常数K和A的转化率都是先增大后减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 温度 | 25 | t1 | t2 |
| 水的离子积 | 1×10-14 | a | 1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高压的条件下,有利于工业上氨气的合成 | |
| B. | 高压比常压有利于合成SO3的反应 | |
| C. | 由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 | |
| D. | 黄绿色的氯水光照后颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com