
分析 (1)n(Cu)=$\frac{3.2g}{64g/mol}$=0.05mol,硝酸过量,Cu完全反应,与硝酸反应生成Cu2+,加水稀释至1000mL,溶液中c(Cu2+)=$\frac{0.05mol}{1L}$=0.05mol/L,结合电荷守恒可计算稀释后溶液的c(H+);
(2)结合电子守恒和N元素守恒计算生成的气体中NO2和NO的物质的量;
(3)NO2和NO的混合气体的平均组成可以表示为NOx,则反应表示为:3NOx+2xNH3=$\frac{3+2x}{2}$N2+3xH2O,据此计算.
解答 解:(1)n(Cu)=$\frac{3.2g}{64g/mol}$=0.05mol,硝酸过量,Cu完全反应,与硝酸反应生成Cu2+,加水稀释至1000mL,溶液中c(Cu2+)=$\frac{0.05mol}{1L}$=0.05mol/L,根据溶液的电荷守恒:2c(Cu2+)+c(H+)=c(NO3-),则c(H+)=0.2moL/L-2×0.05mol/L=0.1mol/L,
故答案为:0.1 mol/L;
(2)设n(NO2)=xmol,n(NO)=ymol,
根据电子守恒,有x+3y=0.05×2,
根据N元素守恒,有x+y=0.03a-0.2,
解之得:x=(0.045a-0.35)mol,y=(0.15-0.015a)mol;
故答案为:(0.045a-0.35)mol;(0.15-0.015a)mol;
(3)NO2和NO的混合气体的平均组成可以表示为NOx,则反应表示为:3NOx+2xNH3=$\frac{3+2x}{2}$N2+3xH2O,若相同状况下1体积NH3与$\frac{6}{7}$体积的NOx刚好完全反应,所以$\frac{2x}{3}=\frac{1}{\frac{6}{7}}$,解得x=1.75,故答案为:1.75.
点评 本题考查混合物计算、根据方程式计算,侧重于学生的分析能力和计算能力的考查,属于字母型计算,增大计算难度,为易错题目,注意利用守恒法计算解答,难度中等


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | △H1>△H2 | B. | △H1<△H2 | C. | △H1﹦△H2 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
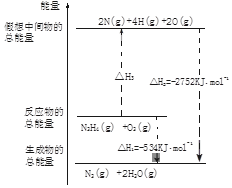 氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用.
氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a<b<0 | B. | b>d>0 | C. | 2a=b<0 | D. | 2c=d>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
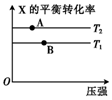 向某密闭容器中充入1mol X与2mol Y发生反应:X(g)+2Y(g)?aZ(g)△H<0,达到平衡后,改变某一条件(温度或容器体积),X的平衡转化率的变化如图所示.下列说法中正确的是( )
向某密闭容器中充入1mol X与2mol Y发生反应:X(g)+2Y(g)?aZ(g)△H<0,达到平衡后,改变某一条件(温度或容器体积),X的平衡转化率的变化如图所示.下列说法中正确的是( )| A. | a=2 | B. | T2>T1 | ||
| C. | A点的反应速率:3v正(X)=v逆(Z) | D. | 表示A、B两点的反应速率:v(A)>v(B) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉、氨水和冰醋酸都属于混合物 | |
| B. | Fe(OH)3胶体无色、透明,能产生丁达尔现象 | |
| C. | 淀粉、纤维素、天然橡胶都是天然高分子化合物 | |
| D. | SiO2既能和NaOH溶液反应又能和氢氟酸反应,所有是两性氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com