
在恒容条件下发生反应A(g)+3B(g)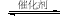 2 C(g)(△H<0),改变其他反应条件,在Ⅰ、Ⅱ阶段体系中各物质浓度随时间变化的曲线如下图所示,下列说法中正确的是
2 C(g)(△H<0),改变其他反应条件,在Ⅰ、Ⅱ阶段体系中各物质浓度随时间变化的曲线如下图所示,下列说法中正确的是
A.第Ⅰ阶段用C表示的平衡前的反应速率v (C)=0.1 mol/(L·s)
B.第Ⅱ阶段中B的平衡转化率αⅡ(B)为0.019
C.第Ⅰ阶段的平衡常数KⅠ与第Ⅱ阶段平衡常数KⅡ的大小关系是:KⅠ﹤KⅡ
D.由第一次平衡到第二次平衡,可能采取的措施是从反应体系中移出产物C
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源:2016届湖南省长沙市高三上学期第三次月考化学试卷(解析版) 题型:实验题
(16)亚氯酸钠(NaClO2)是重要漂白剂,探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体按如下图装置进行制取。

已知:NaClO2饱和溶液在低于38℃时析出NaClO2•3H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)装置C的作用是 ;
(2)已知装置B中的产物有ClO2气体,则装置B中反应的方程式为 ;装置D中反应生成NaClO2的化学方程式为 ;装置B中反应后的溶液中阴离子除了ClO2﹣、ClO3﹣、Cl﹣、ClO﹣、OH﹣外还可能含有的一种阴离子是 ;检验该离子的方法是 ;
(3)请补充从装置D反应后的溶液中获得NaClO2晶体的操作步骤。
①减压,55℃蒸发结晶;② ;③用38℃~60℃热水洗涤;④低于60℃干燥;得到成品.
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是 ;
实验Ⅱ:样品杂质分析与纯度测定
(5)测定样品中NaClO2的纯度.测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2﹣+4I﹣+4H+=2H2O+2I2+Cl﹣,将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液做指示剂,用c mol•L﹣1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2+2S2O32﹣=2I﹣+S4O62﹣)。请计算所称取的样品中NaClO2的物质的量为 。
查看答案和解析>>
科目:高中化学 来源:2016届吉林省扶余市高三上学期第一次月考化学试卷(解析版) 题型:选择题
向溶液中分别通入足量的相应气体后,下列各组离子还能大量存在的是
A.氯气:K+、Na+、SO32-、NO3-
B.氨气:K+、Na+、AlO2-、CO32-
C.二氧化硫:Na+、NH4+、SiO32-、C1-
D.乙烯:H+、K+、MnO4-、SO42-
查看答案和解析>>
科目:高中化学 来源:2016届山东省淄博市高三上学期10月月考化学试卷(解析版) 题型:实验题
(8分)实验室配制物质的量浓度均为0.2mol/L 的NaCl溶液和稀硫酸各500mL.提供的试剂是:NaCl固体和98%的浓硫酸(密度为1.84g/cm3)及蒸馏水.
(1)应用托盘天平称量NaCl g,应用量筒量取浓硫酸 mL;
(2)配制两种溶液时都需要的仪器是 ;
(3)稀释浓硫酸时应注意 ;
(4)在配制上述溶液实验中,下列操作引起结果偏低的有 (填序号)
A、在烧杯中溶解溶质搅拌时,溅出少量溶液
B、没有用蒸馏水洗烧杯2~3次,并将洗液移入容量瓶中
C、定容时,加水超过了刻度线,倒出一些再重新加水到刻度线
D、将所配溶液从容量瓶转移到试剂瓶时,有少量溅出
E、把配好的溶液倒入刚用蒸馏水洗净的试剂瓶中备用
F、容量瓶刚用蒸馏水洗净,没有烘干
G、量筒量取浓H2SO4后没有用蒸馏水洗涤2~3次,并将洗液移入容量瓶中.
查看答案和解析>>
科目:高中化学 来源:2016届山西省校高三上学期阶段性考试化学试卷(解析版) 题型:选择题
化学实验中常将溶液或试剂进行酸化,下列酸化处理的措施正确的是
A.检验溶液中是否含有SO32-时,用硝酸酸化后再加BaCl2溶液
B.为提高高锰酸钾溶液的氧化能力,用盐酸将高锰酸钾溶液酸化
C.检验溶液中是否含有Fe2+时,用硝酸酸化后,加KSCN溶液
D.检验溶液中是否含有SO42-时,用盐酸酸化后,加BaCl2溶液
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三上学期开学联考化学试卷(解析版) 题型:填空题
100mL某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32﹣、SO42﹣、NO3﹣中的几种.①若加入锌粒,会产生H2;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.
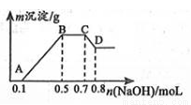
则:
(1)溶液中一定含有的阳离子有 ,一定不含有的离子有 .
(2)C→D的离子方程式为 .
(3)由A→B及C→D段有关数据可计算出的某两种离子的物质的量浓度分别为 mol•L﹣1和 mol•L﹣1.
查看答案和解析>>
科目:高中化学 来源:2016届福建省四地六校高三上学期第一次联考化学试卷(解析版) 题型:选择题
下列叙述中正确的是
A.摩尔是物质的质量的单位
B.碳的摩尔质量为12g
C.阿伏加德罗常数约为6.02×1023mol﹣1
D.气体摩尔体积为22.4L/mol
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高二上学期第一次月考化学试卷(解析版) 题型:选择题
在氨水中存在下列电离平衡:NH3·H2O NH4++OH-,下列情况能引起电离平衡向正向移动的有①加NH4Cl固体 ②加NaOH溶液 ③加HCl ④加CH3COOH溶液 ⑤加水 ⑥加压
NH4++OH-,下列情况能引起电离平衡向正向移动的有①加NH4Cl固体 ②加NaOH溶液 ③加HCl ④加CH3COOH溶液 ⑤加水 ⑥加压
A.③④⑤ B.①④⑥
C.①③⑤ D.①②④
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三上学期10月月考化学试卷(解析版) 题型:推断题
(12分)在下列物质转化关系中,A是(NH4)2S,D的相对分子质量比C的相对分子质量大16,E是酸,当X无论是强酸还是强碱时,都有如图的转化关系:
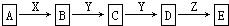
请回答:
(1)当X是强酸时A、B、C、D、E均含同一种元素。则E是__________________,写出B生成C的化学方程式________________。
(2)当X是强碱时,A、B、C、D、E均含另外同一种元素。则E是_____________,写出B生成C的化学方程式________________。
(3)X无论是强酸还是强碱,上述转化中Z是同一种物质,写出Z的电子式_________________。
(4)同温同压下,分别在强酸和强碱条件下生成的气体B在等质量时的体积比为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com