
【题目】ClO2气体是一种常用的消毒剂,我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒.
(1)消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,在这个过程中,Fe2+、Mn2+的化合价升高,说明ClO2具有______性.
(2)工业上可以通过下列方法制取ClO2,请完成该化学反应方程式:2KClO3+SO2==2ClO2+_____。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,写出化学方程式:_____________
(4)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8mg/L之间。碘量法可以检测水中ClO2的浓度,步骤如下:
Ⅰ取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝。
Ⅱ加入一定量的Na2S2O3溶液。(已知:2S2O32-+I2== S4O62-+2I-)
Ⅲ加硫酸调节水样pH至1~3。
操作时,不同pH环境中粒子种类如图所示:

请回答:
①操作Ⅰ中反应的离子方程式是_____。
②在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是_____。
③若水样的体积为1.0L,在操作Ⅱ时消耗了1.0×10-3mol/L的Na2S2O3溶液10ml,则水样中ClO2的浓度是_____ mg/L。
【答案】氧化性 K2SO4 2Cl2 + 2H2O(g)+ C═4HCl + CO2 2ClO2 + 2I- = 2ClO2- + I2 ClO2- + 4I- + 4H+ = Cl- + 2I2 + 2H2O 0.675
【解析】
(1)在这个过程中,Fe2+、Mn2+的化合价升高,则ClO2的化合价降低,为氧化剂,具有氧化性,故答案为:氧化性;
(2)质量守恒可得:2KClO3+SO2=2ClO2+K2SO4,故答案为:K2SO4;
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2是放热反应,化学方程式为2Cl2 + 2H2O(g)+ C═4HCl + CO2,故答案为:2Cl2 + 2H2O(g)+ C═4HCl + CO2;
(4)①用氢氧化钠溶液调至中性,由图知,此条件下粒子种类为 ClO2,ClO2将加入的碘化钾氧化为I2,自身被还原成ClO2-,离子方程式为:2ClO2 + 2I- = 2ClO2- + I2,故答案为:2ClO2 + 2I- = 2ClO2- + I2;
②由图示表明,pH至1~3时,ClO2-将I-氧化成I2,离子方程式为:ClO2- + 4I- + 4H+ = Cl- + 2I2 + 2H2O;故答案为:ClO2- + 4I- + 4H+ = Cl- + 2I2 + 2H2O;
③S2O32- ~ I- ~ ClO2
1 1 1
1.0×10-3 mol/L×0.01L 1.0×10-5mol
m(ClO2)=n(ClO2)×M(ClO2)=1.0×10-5mol×67.5×103mgmol-1=0.675mg,由于水样为 1L,所以 ClO2 的浓度为![]() =0.675 mgL-1,故答案为:0.675。
=0.675 mgL-1,故答案为:0.675。


科目:高中化学 来源: 题型:
【题目】肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,生成N2和水蒸气。已知:N2(g)+2O2(g)====N2O4(g) ΔH="+8.7" kJ·mol-1
N2H4(g)+O2(g) ====N2(g)+2H2O(g) ΔH="-534.0" kJ·mol-1
下列表示肼跟N2O4反应的热化学方程式,正确的是( )
A. 2N2H4(g)+N2O4(g) ====3N2(g)+4H2O(g)ΔH="-542.7" kJ·mol-1
B. 2N2H4(g)+N2O4(g) ====3N2(g)+4H2O(g)ΔH="-1" 059.3 kJ·mol-1
C. N2H4(g)+1/2 N2O4(g) ====3/2N2(g)+2H2O(g)ΔH="-1" 076.7 kJ·mol-1
D. 2N2H4(g)+N2O4(g) ====3N2(g)+4H2O(g)ΔH="-1" 076.7kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在生产和日常生活中有着重要的应用。下列说法不正确的是:
A. 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B. 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
C. MgO 的熔点很高,可用于制作耐高温材料
D. 电解MgCl2饱和溶液,可制得金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫是生物必需的大量营养元素之一,下图是自然界中硫的循环图,请分析此图并回答有关问题。

(1)氮循环和硫循环是自然界中两种重要的元素循环过程,下列关于这两种循环的说法正确的是________。
选项 | 比较 | 氮循环 | 硫循环 |
A | 异 | 氮元素会进入大气 | 硫元素不会进入大气 |
B | 氮循环过程有生物圈参与 | 硫循环过程无生物圈参与 | |
C | 同 | 人类活动对氮循环和硫循环都造成巨大影响 | |
D | 氮循环和硫循环对环境的影响是都能导致温室效应 | ||
(2)分解者可将含硫有机物分解为H2S,硫磺细菌和硫化细菌可将H2S进一步变为硫单质或硫酸盐,下列关于硫化氢说法正确的是_______。
A.H2S分子很稳定,受热难分解
B. H2S分子中所有原子的最外层都达到8电子结构
C.将H2S通入FeSO4溶液,产生沉淀
D.H2S中硫元素为-2价,因此H2S只有还原性,没有氧化性
E.H2S是一种无色臭鸡蛋气味的有毒气体
(3)大气中的SO2经过一系列转化最终生成H2SO4,导致降水具有较强酸性,称为酸雨。检验某次降雨是否为酸雨的方法是_________________,收集某次酸雨样品,发现8小时内,样品pH一直在减小,其原因可能是________________。(用化学方程式表示)
(4)为了防治酸雨,工业上常采用“钙基固硫法”即将生石灰和含硫的煤混合后燃烧,燃烧时硫、氧气和生石灰共同作用,使硫元素转移到炉渣中,大部分硫元素最终转化为固体盐是_______(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向FeCl3溶液中加入Na2SO3溶液,测定混合后溶液pH随混合前溶液中c(SO32-)/c(Fe3+)变化的曲线如图所示。实验发现:
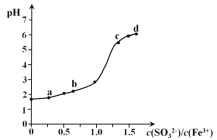
i. a点溶液透明澄清,向其中滴加NaOH溶液后,立即产生灰白色沉淀,滴入KSCN溶液显红色;
ii. c点和d点溶液中产生红褐色沉淀,无气体逸出。取其上层清液滴加NaOH溶液后无明显现象,滴加KSCN溶液显红色。下列分析合理的是
A. 向a点溶液中滴加BaCl2溶液,无明显现象
B. b点较a点溶液pH升高的主要原因:2Fe3+ + SO32- + H2O === 2Fe2+ + SO42- + 2H+
C. c点溶液中发生的主要反应:2Fe3+ + 3SO32- + 6H2O![]() 2Fe(OH)3↓+ 3H2SO3
2Fe(OH)3↓+ 3H2SO3
D. 向d点上层清液中滴加KSCN溶液,溶液变红;再滴加NaOH溶液,红色加深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NA表示阿伏加德罗常数,下列说法中正确的是( )
A.53g碳酸钠中含NA个CO32-
B.0.1molOH-含NA个电子
C.1.8g重水(D2O)中含NA个中子
D.标准状况下11.2L SO3中含NA个硫原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用图所示实验装置探究钢丝与过量浓硫酸的反应。下列描述不合理的是( )
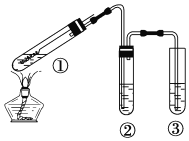
A. 该反应中浓硫酸表现了强氧化性和酸性
B. ②中选用品红溶液验证SO2的生成
C. ③中选用NaOH溶液吸收多余的SO2
D. 为确认CuSO4生成,向①中加水,观察颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如图所示;下列描述错误的是:

A. 淡化海水的方法主要有蒸馏法、电渗析法、离子交换法
B. 以NaCl为原料可以生产烧碱、纯碱、金属钠、氯气、盐酸等化工产品
C. 步骤Ⅱ中鼓入热空气吹出溴,是因为溴蒸气的密度比空气的密度小
D. 用SO2水溶液吸收Br2的离子反应方程式为:Br2+SO2+2H2O═4H++SO42﹣+2Br﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | M层上电子数是K层上电子数的3倍 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
(1)元素X位于元素周期表的第____周期第__族,它的一种核素可测定文物年代,这种核素的符号是____。
(2)元素Y的原子结构示意图为___,与氢元素形成一种离子YH4+,写出某溶液中含有该微粒的检验方法_____。
(3)元素Z与元素T相比,非金属性较强的是___(用元素符号表示),下列表述中能证明这一事实的是___。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物对应的水化物中化学性质明显不同于其他三种的是____,理由______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com