
在0.lmol•L-1Na2CO3溶液中,下列关系正确的是 ( )
A.[Na+]=2[CO32-] B.[OH一 ]=2[H+]
C.[HCO3- ]>[H2CO3] D.[Na+]<([CO32-]+[HCO3-])
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省济宁市高三第二次模拟考试理综化学试卷(解析版) 题型:计算题
PM2.5(可入肺颗粒物)污染跟冬季燃煤密切相关,燃煤还同时排放大量的CO2、SO2和NOx
(1)最近有科学家提出构想:把空气吹入饱和碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。
①已知在常温常压下:
2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g) ∆H = -1275.6 kJ/mol
2CO(g)+O2(g)=2CO2(g) ∆H = -566.0 kJ/mol
H2O(g)=H2O(1) ∆H = -44.0 kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________________。
②以甲醇和氧气反应制成的燃料电池如图所示,该电池工作过程中O2应从______(填“c”或“b”)口通入,电池负极反应式为__________________。

③25℃时,将甲醇燃烧生成的足量CO2通入到浓度为0.lmol·L-1,NaOH溶液中,所得溶液的pH=8,溶液中离子浓度由大到小的顺序是_________________。
(2)已知在一定条件下,NO与NO2存在下列反应:NO(g)+NO2(g)=N2O3(g),ΔH<0若该反应在绝热、恒容的密闭体系中进行,下列示意图能说明tl时刻达到平衡状态的是____________。

(3)在一个固定容积为5L的密闭容器中充入0.20molSO2和0.l0molO2,半分钟后达到平衡,测得容器中含SO30.18mol,则v(O2)=__________,若继续通入0.20mo1SO2和0.lmolO2,则平衡____________移动(填“向正反应方向”、“向逆反应方向”或“不”)。
(4)在一定条件下,NO2可以被NH3还原为N2来消除NO2对环境造成的污染。25℃时,将NH3溶于水得l00mL 0.lmol·L-的氨水,测得pH=11,则该条件下NH3·H2O的电离平衡常数约为___________。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年重庆市高三5月月考(理综)化学部分 题型:填空题
I.(1)CH3OH(1)、H2的燃烧热分别为:725.5 kJ/mol和285.8 kJ/mol,写出工业上以CO2、H2合成CH3OH(1)的热化学方程式: 。
(2)右图为光电解水的装置,写出光照时半导体电极表面发生的电极反应式________。目前应用最多的半导体材料是Si,甚至有人提出硅是“21世纪的能源”,硅可作为新能源的原因可能的是 (填字母)。
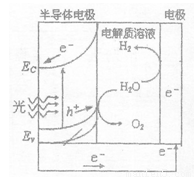
a.在自然界中存在大量的单质硅
b.硅可以通过化学方法“再生”
c.硅具有较强的亲氧性,燃烧放出的热量多
d.硅的化学性质不活泼,便于安全贮存、运输
II.将0.2mol/L HA溶液与O.lmol/L NaOH溶液等体积混合,测得混合溶液c(Na+)>c(A—),
用“>”、“<”或“=”填写下列空白:
(1)混合溶液中c(A—)____c(HA);c(HA)+c(A—)__0.lmol/L;
(2)混合溶液中,由水电离出来的c(OH—) 0.2mol/L HA溶液中由水电离出的c(H+)
(3)25℃时,如果取0.2mol/L HB溶液与0.lmol/L NaOH溶液等体积混合,测得混合溶液的pH <7,则HB的电离程度 NaB的水解程度。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江西省吉安市高三第三次模拟考试(理综)化学部分 题型:填空题
A、B、C、D是短周期元素形成的四种气体单质,其它物质为化合物。H常作为普通锌锰干电池的电解质。有关的转化关系如下图所示(反应条件均已略去)。
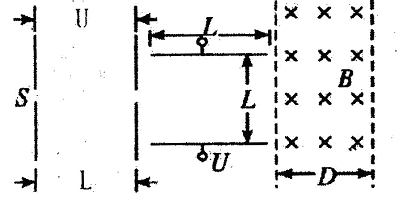
请回答下列问题:
(1)B的结构式为____ ,G的化学式为 。
(2)Y和E在一定条件下可反应生成B和Z,该反应的化学方程式为 。
(3)在体积为0.5L的恒容密闭容器中,充人1.25molB和1.25molD进行如下化学反应:
B(g)+3D(g) 2Y(g),其化学平衡常数K与T的关系如下表所示:
2Y(g),其化学平衡常数K与T的关系如下表所示:
|
T/℃ |
300 |
400 |
|
K |
3.41 |
0.50 |
①若反应在400℃下进行,下列各项中能作为判断该反应达到化学平衡状态依据的是
(填字母)。
A.Y、B、D的物质的量分别为0.50mol、l.0mol、0.50mol
B.v正(B)= 3v 逆(D)
C.容器内压强保持不变
D.混合气体的密度保持不变
②在一定条件下B(g)+3D(g) 2Y(g)达到平衡状态,时间为t1时改变条件。化学反应速率与反应时间的关系如图。下列说法中正确的是( )
2Y(g)达到平衡状态,时间为t1时改变条件。化学反应速率与反应时间的关系如图。下列说法中正确的是( )
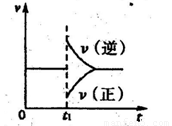
A.维持温度、反应体系体积不变,t1时充入Y(g)
B.维持压强不变,tl时升高反应体系温度
C.维持温度不变,t1时扩大反应体系体积
D.维持温度、压强不变,t1时充入Y(g)
(4)0.lmol·L-1的X溶液和0.2mol·L-1的Y溶液等体积混合后显碱性,则该混合溶液中各离子浓度大小顺序是 .
(5)常温下,0.1mol·L-1的Y溶液中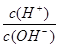 =l×10-8,下列叙述中错误的是 ( )
=l×10-8,下列叙述中错误的是 ( )
A.该溶液的pH=11
B.该溶液中的溶质电离出的阳离子浓度为0.1mol·L-1
C.该溶液中水电离出的c(H+)与c(OH—)乘积为l×10-22
D.pH=l的X溶液V1L与0.1mol·L-1的Y溶液V2L混合,若混合溶液pH =7,则V1<V2
E.将0.1mol·L-1的Y溶液加水稀释100倍后,pH >9
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各溶液中,微粒的物质的量浓度关系正确的是:
A.常温下,在pH=8的NaA溶液中:c(Na+)-c(A-)=9.9×10-7mol/L
B.由10mLO.lmol/L的CH3COOH溶液与10mL0.lmoL/L的NaOH溶液混合,浓度大小的顺序
为:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
c.室温下,由pH=l的CH3COOH溶液与pH=13的NaOH溶液等体积混合,浓度大小的顺序为:
c(Na+)>c(CH3COO-)>c(OH-)>(H+)
D.常温下,0.lmol/LpH=8的NaHB溶液中: c(HB-)>c(B2-)>c(H2B)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com