
【题目】水处理技术在生产、生活中应用广泛,对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施.
(1)水的净化和软化的区别是水的净化是用混凝剂将水中的胶体及悬浮物沉淀下来,而水的软化是;
(2)生活用水必须保证安全,自来水厂需要对取自江河湖泊中的淡水进行杀菌消毒、混凝沉淀、过滤等工艺处理,这三项处理的正确顺序是;
(3)下列试剂能够用来对自来水进行杀菌消毒,且不会造成二次污染的是(填字母).
a.福尔马林 b.漂白粉 c.氯气 d.臭氧
(4)Na2FeO4是一种新型水处理剂,工业上可用FeSO4制备Na2FeO4其工艺流程如下: ![]()
①工业上常用硫酸亚铁作混凝剂除去天然水中含有的悬浮物和胶体,为了达到更好的效果,要将待处理水的pH调到9左右,再加入绿矾.请解释这一做法的原因(用必要的离子方程式和文字描述).
②写出由Fe(0H)3制取Na2FeO4的化学方程式;
(5)石灰纯碱法是常用的硬水软化方法,已知25℃时Ksp(CaCO3)=2.8×10﹣9 , 现将等体积的Ca(OH)2溶液与Na2CO3溶液混合(假设溶液体积具有加和性),若Na2CO3溶液的浓度为5.6×10﹣5molL﹣1 , 则生成沉淀所需Ca(0H)2溶液的最小浓度为 .
【答案】
(1)除去水中较多的钙离子和镁离子
(2)混凝沉淀→过滤→杀菌消毒
(3)d
(4)Fe2+在碱性条件下易被氧化成Fe3+ , 进而水解生成Fe(OH)3胶体,起到较好的混凝作用,4Fe2++O2+2H2O+8OH﹣═4Fe(OH)3(胶体);2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3NaCl+5H2O
(5)2×10﹣4mol/L
【解析】 解:(1)水的净化和软化的区别是水的净化是用混凝剂将水中的胶体及悬浮物沉淀下来,而水的软化是除去水中较多的钙离子和镁离子,所以答案是:除去水中较多的钙离子和镁离子;(2)生活用水必须保证安全,自来水厂需要对取自江河湖泊中的淡水进行杀菌消毒、混凝沉淀、过滤等工艺处理,这三项处理的正确顺序是混凝沉淀→过滤→杀菌消毒,所以答案是:混凝沉淀→过滤→杀菌消毒;(3)福尔马林有毒,含氯物质可导致二次污染,则能够用来对自来水进行杀菌消毒,且不会造成二次污染的只有臭氧,所以答案是:d;(4)①工业上常用硫酸亚铁作混凝剂除去天然水中含有的悬浮物和胶体,为了达到更好的效果,要将待处理水的pH调到9左右,再加绿矾,原因:Fe2+在碱性条件下易被氧化成Fe3+ , 进而水解生成Fe(OH)3胶体,起到较好的混凝作用,4Fe2++O2+2H2O+8OH﹣=4Fe(OH)3(胶体),所以答案是:Fe2+在碱性条件下易被氧化成Fe3+ , 进而水解生成Fe(OH)3胶体,起到较好的混凝作用,4Fe2++O2+2H2O+8OH﹣═4Fe(OH)3(胶体);②由Fe(0H)3制取Na2FeO4的化学方程式为2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3NaCl+5H2O,所以答案是:2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3NaCl+5H2O;(5)Na2CO3溶液的浓度为5.6×10﹣5mol/L,等体积混合后溶液中c(CO32﹣)= ![]() ×5.6×10﹣5mol/L=2.8×10﹣5mol/L,根据Ksp=c(CO32﹣)c(Ca2+)=2.8×10﹣9可知,c(Ca2+)=
×5.6×10﹣5mol/L=2.8×10﹣5mol/L,根据Ksp=c(CO32﹣)c(Ca2+)=2.8×10﹣9可知,c(Ca2+)= ![]() mol/L=1×10﹣4mol/L,原溶液Ca(OH)2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液Ca(OH)2溶液的最小浓度为2×1×10﹣4mol/L=2×10﹣4mol/L,所以答案是:2×10﹣4mol/L.
mol/L=1×10﹣4mol/L,原溶液Ca(OH)2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液Ca(OH)2溶液的最小浓度为2×1×10﹣4mol/L=2×10﹣4mol/L,所以答案是:2×10﹣4mol/L.


科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,利用煤化工中生产的CO和H2可制取甲醇,发生的反应为CO(g)+2H2(g) ![]() CH3OH(g) △H=-99kJ/mol。
CH3OH(g) △H=-99kJ/mol。
(1)关于该反应的下列说法,错误的是___________。
A.消耗CO和消耗CH3OH的速率相等时,说明该反应达到平衡状态
B.升高温度,正反应速率减小,逆反应速率增大
C.使用催化剂,可以提高CO的转化率
D.增大压强,该反应的化学平衡常数不变
(2)在某温度时,将1.0mol CO 与2.0 mol H2充入2 L的空钢瓶中,发生上述反应,在第5 min时达到化学平衡状态,此时甲醇的物质的量分数为10%。甲醇浓度的变化状况如图所示:

①从反应开始到5 min 时,生成甲醇的平均速率为________。
②5 min 时达到平衡,H2的平衡转化率α=_____%.化学平衡常数K= _______。
③1min 时的v正(CH3OH)______ 4min 时v逆(CH3OH ) (填“大于“小于“或“等于”)。
④若将钢瓶换成同容积的绝热钢瓶,重复上述实验,平衡时甲醇的物质的量分数_____0.1(填“>”“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列物质按酸、碱、盐分类排列,正确的是( )
A. 硫酸 纯碱 硫酸钙 B. 盐酸 烧碱 硫酸亚铁
C. 碳酸 乙醇 烧碱 D. 磷酸 熟石灰 苛性钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子方程式H+ + OH-= H2O可表示的化学方程式是( )
A. 盐酸与氢氧化铜的反应 B. 硫酸氢钠与氢氧化钠的反应
C. 硫酸与氢氧化镁的反应 D. 盐酸与氨水的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”。近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。
(1)硫酸工业排出的尾气(主要含SO2)有多种处理方式。
①写出用过量氨水吸收尾气的离子方程式:___________________。
②尾气也可用软锰矿浆(MnO2)吸收,写出如图所示“反应1”的化学方程式:___________________。
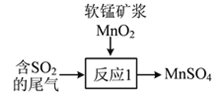
(2)治理汽车尾气中NO和CO的方法之一是在汽车的排气管上装一个催化转化装置,使NO和CO在催化剂作用下转化为无毒物质。写出该反应的化学方程式:___________________。
(3)某工厂拟综合处理含NH废水和工业废气(主要含N2、Cl2、NO),设计了如下流程:

①“反应1”用于吸收Cl2,“反应1”的化学方程式为___________________。
② “反应2”的离子方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 物质的量就是物质的质量
B. 摩尔是国际单位制中七个基本单位之一
C. 摩尔既是物质的量的单位,又是粒子的数量单位
D. 阿伏加德罗常数就是6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸(H2FeCO4)是一种多功能、高效无毒的新型绿色水处理剂,投入水中会迅速发生反应。
(1)Na2FeO4中Fe的化合价为______________________。.
(2)已知:常温下高铁酸为紫黑色固体,将H2FeO4投入水中,有气体生成,同时有红褐色沉淀产生,则H2FeO4与水反应的化学方程式为__________________。
(3)在工业上制备Na2FeO4的方法有多种。
Ⅰ.干法制备的反应原理如下:
2FeSO4+6Na2O2=aNa2FeO4+M↑+2Na2O+2Na2SO4
①a=_____________。
②每生成1mol M,该反应转移电子的物质的量为_________mol。
Ⅱ.湿法制备的工艺流程如下:

己知:Na2FeO4在强碱性溶液中的溶解度较小。
③反应a中,生成物除了Na2FeO4外,另一种盐的化学式为 _____________。
④一系列操作包括过滤、___________、_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题. 
(1)①打开K2 , 合并K1 . A电极可观察到的现象是;B极的电极反应式为 .
②打开K1 , 合并K2 .
A电极可观察到的现象是;
B极的电极反应为 .
(2)判断原电池的正负极时,不仅要看金属活泼性顺序,还要注意此金属在电解质溶液中的活泼性.试回答下列问题:将铝片和铜片用导线连接,若插入浓硝酸中形成原电池,负极是 , 若插入氢氧化钠溶液中形成原电池,负极是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com