
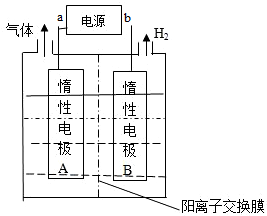
| A. | 外加电源的a极为正极 | |
| B. | 电解过程中,Li+向B极迁移 | |
| C. | 阳极反应式为:4OH--4e-═O2↑+H2O | |
| D. | 每生成1molLiOH,外电路转移1mol电子 |
分析 电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液,由图可知,右侧生成氢气,则B中氢离子放电,可知B为阴极,在B中制备LiOH,Li+由A经过阳离子交换膜向B移动;A中为LiCl溶液,氯离子放电生成氯气,据此回答.
解答 解:A、电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液,由图可知,右侧生成氢气,则B中氢离子放电,可知B为阴极,A为阳极,a是正极,故A正确;
B、电解过程中Li+向阴极即向B电极迁移,故B正确;
C、电解池的阳极上是氯离子失电子,电极反应式为:2Cl--2e-═Cl2↑,故C错误;
D、电解制备LiOH,B为阴极,在B中制备LiOH,每生成1molLiOH,外电路转移电子是1mol,故D正确;
故选C.
点评 本题是一道高考题的改编题,侧重电解原理的应用知识,注意知识的迁移和应用是解题的关键,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度 | pH=7 | pH=6 | pH=5 | pH=3 |
| 20℃ | 300 | 240 | 160 | 58 |
| 30℃ | 160 | 108 | 40 | 20 |
| 50℃ | 80 | 50 | x | 8 |
| A. | x可能为42 | |
| B. | 其他条件不变,在30°、pH=4下的反应速度比40℃、pH=6时快 | |
| C. | 根据单一变量法,无法比较温度、pH均不同的两组实验的反应速率较慢 | |
| D. | 30℃,pH=3条件下,KI的反应速率为v(KI)=0.005mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6 g | B. | 11.2 g | C. | 22.4 g | D. | 20.16 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 结合如表回答下列问题(均为25℃时的数据)
结合如表回答下列问题(均为25℃时的数据)| 酸 | 电力平衡常数(Ka) | 酸 | 电力平衡常数(Ka) |
| CH3COOH | 1.7×10-5 | H3BO3 | 5.8×10-10 |
| H2CO3 | Ka1=4.2×10-7 Ka2=5.6×10-11 | HNO2 | 7.1×10-4 |
| HCN | 6.2×10-10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用无磷洗衣粉,可彻底解决水体富营养化问题 | |
| B. | SO2是大气污染物,可以用生石灰除去工业废气中的SO2 | |
| C. | 明矾水解产生Al(OH)3胶体粒子,可除去悬浮物 | |
| D. | 使用清洁能源是防止酸雨发生的重要措施之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,1mol CO2和CO混合气体含有的碳原子数为NA | |
| B. | 在KIO3+6HI═KI+3I2+3H2O反应中,每生成 3molI2,则转移6NA个电子 | |
| C. | 78gNa2O2与足量的CO2完全反应,转移的电子总数为NA | |
| D. | 在1L0.1mol-L-1 Na2S溶液中,阴离子总数大于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 (填分子式),其原因是在双氧水分子中每个H原子和O原子形成一对共用电子对,O原子之间共用一对电子,这样每个原子都达到稳定结构.
(填分子式),其原因是在双氧水分子中每个H原子和O原子形成一对共用电子对,O原子之间共用一对电子,这样每个原子都达到稳定结构.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com