
【题目】X、Y、Z、W是原子序数依次增大的短周期主族元素。Y、Z同周期且相邻,X、W同主族且与Y处于不同周期,Y、Z原子的电子总数与X、W原子的电子总数之比为5:4。下列说法正确的是( )
A.原子半径:W>Z>Y>X
B.Y的简单气态氢化物的热稳定性比Z的强
C.由X、Z组成的化合物与由Z、W组成的化合物只能发生化合反应
D.由X、Y、Z三种元素组成的化合物可以是酸、碱或盐
 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
【题目】锂锰电池结构如图所示,其中电解质![]() 溶于混合有机溶剂中,
溶于混合有机溶剂中,![]() 通过电解质迁移入
通过电解质迁移入![]() 晶格中生成
晶格中生成![]() 。下列有关说法正确的是
。下列有关说法正确的是
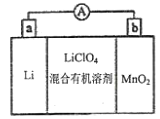
A. 外电路电流方向:a→b
B. 电池正极反应式为:![]()
C. 可以用水代替电池中的混合有机溶剂
D. 用该电池给铅蓄电池充电,a极与Pb电极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍及其化合物的应用正日益被重视。
(1)最重要的含铍矿物是绿柱石,含2%铬(Cr)的绿柱石即为祖母绿。基态Cr原子价电子的排布图为_______。
(2)铍与相邻主族的铝元素性质相似。下列有关铍和铝的叙述正确的有_____(填字母)。
A.都属于p区主族元素 B.电负性都比镁大
C.第一电离能都比镁大 D.氯化物的水溶液pH均小于7
(3)铍、铝晶体都是由金属原子密置层在三维空间堆积而成(最密堆积)。铍的熔点(1551K)比铝的熔点(930K)高,原因是____。
(4)氯化铍在气态时存在BeCl2分子(a)和二聚分子(BeCl2)2(b),固态时则具有如下图所示的链状结构(c)。
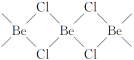
①a属于____(填“极性”或“非极性”)分子。
②二聚分子(BeCl2)2中Be原子的杂化方式相同,且所有原子都在同一平面上。b的结构式为____(标出配位键)。
(5)Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所:
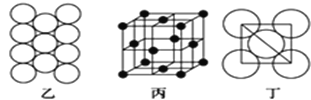
若已知Al的原子半径为d,NA代表阿伏加德罗常数,Al的相对原子质量为M,则一个晶胞中Al原子的数目为___个;Al晶体的密度为_____(用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率、化学反应限度的说法中,正确的是( )
A.反应C(s)+H2O(g)![]() CO(g)+H2(g),增加碳的用量可加快反应速率
CO(g)+H2(g),增加碳的用量可加快反应速率
B.用铁片与稀硫酸反应制H2,改用 98%的浓硫酸可加快生成H2的速率
C.反应2SO2(g)+O2(g)![]() 2SO3(g)在密闭容器中进行,压缩容器体积,反应速率增大
2SO3(g)在密闭容器中进行,压缩容器体积,反应速率增大
D.可逆反应达到化学平衡状态时,正、逆反应的速率相等且都为0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列卤代烃既能发生消去反应生成烯烃,又能发生水解反应生成醇的是
①![]() ②CH3CH2CH2Br ③CH3F④CH3CH2Br ⑤C(CH3)3CH2Br⑥CH(CH3)2C(CH3)2Br
②CH3CH2CH2Br ③CH3F④CH3CH2Br ⑤C(CH3)3CH2Br⑥CH(CH3)2C(CH3)2Br
A. ①③⑤B. ②④⑥C. ③④⑤D. ①②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)可用作分析试剂、基准试剂、还原剂、除氯剂等。
Ⅰ、实验室制备硫代硫酸钠装置图如下。

(1)仪器B的名称是________。
(2)写出装置B制备Na2S2O3的化学反应方程式____________________________。
(3)NaOH溶液的作用是____________________________________。
Ⅱ、测硫代硫酸钠样品纯度步骤如下
①称取Ⅰ中制得硫代硫酸钠样品8.0g配成250mL溶液
②从①中量取20.00mL溶液于锥形瓶中
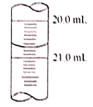
③用0.lmol·L-1标准碘液滴定,实验测得数据如下
滴定前读数(mL) | 滴定后读数(mL) | 待测液体积(mL) | |
实验一 | 1.20 | 21.00 | 20.00 |
实验二 | 0.40 | 19.20 | 20.00 |
实验三 | 0.50 | x | 20.00 |
(4)该滴定时,向锥形瓶中加入1至2滴淀粉液作指示剂,则达到滴定终点的判断标准是______________。
(5)x读数如图所示,则x=________,根据所测的数据计算该硫代硫酸钠样品纯度为_______________。(已知I2+2Na2S2O3=2NaI+Na2S4O6)
(6)若步骤①中量取20.00mL硫代硫酸钠溶液时,未用硫代硫酸钠溶液润洗滴定管,则测得样品的纯度将______________(填“偏大”或“偏小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y在周期表中的相对位置如图所示,且已知X基态原子的价电子排布为nsnnpn+1,下列说法不正确的是( )
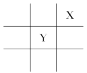
A. X元素的电负性大于YB. X元素的第一电离能大于Y
C. X在周期表中位于第二周期第ⅢA族D. 原子半径Mg>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中铝元素主要存在于铝土矿(主要成分为Al2O3、FeO、Fe2O3、SiO2)中,铝的单质及其化合物在生产、生活、科研等领域应用广泛。工业上用铝土矿制备铝的某种化合物的工艺流程如下:
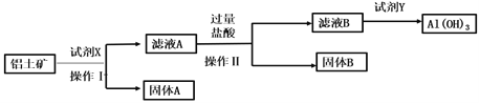
下列说法错误的是( )
A.在实验室实施操作Ⅰ需要的玻璃仪器是漏斗、烧杯、玻璃棒
B.为使铝元素全部转化为Al(OH)3,每一步操作的试剂均需过量
C.将试剂X与操作Ⅱ的试剂过量盐酸互换,也可制得Al(OH)3
D.固体A的主要成分是FeO和Fe2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的工业制备原理的方程式书写正确的是
A.氢氧化钠:Na2CO3+Ca(OH)2![]() CaCO3↓+2NaOH
CaCO3↓+2NaOH
B.乙醇:C6H12O6![]() 2C2H5OH+2CO2↑
2C2H5OH+2CO2↑
C.二氧化硫:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
D.氯气:Ca(ClO)2+4HCl(浓)![]() CaCl2+2Cl2↑+2H2O
CaCl2+2Cl2↑+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com