
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:解答题
| 实验步骤 | 有关问题 |
| (1)计算KCl所需的质量 | 需要的KCl质量为7.5g |
| (2)称量KCl固体 | 称量过程中主要用到的仪器是托盘天平、药匙 |
| (3)将KCl加入100mL的烧杯中,加适量蒸馏水溶解 | 为加快溶解,可采取的措施是搅拌、加热、研细氯化钾等措施 |
| (4)将烧杯中的溶液转移至500mL容量瓶中 | 为防止溶液溅出,应该采取的措施是 玻璃棒引流 |
| (5)向容量瓶中加蒸馏水至刻度线 | 在进行此操作时应注意的问题是 加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹液面与刻度线水平相切. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
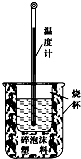 实验室利用如图装置进行中和热的测定.回答下列问题:
实验室利用如图装置进行中和热的测定.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠放入水中:Na+2H+=2Na++H2↑ | |
| B. | 铜粉放入硝酸银溶液里:Cu+2Ag+=Cu2++2Ag | |
| C. | 氢氧化钡跟硫酸铜溶液的反应:Ba2++2OH-+Cu2++SO2-4=BaSO4↓+Cu(OH)2↓ | |
| D. | 氯化铁溶液中滴加硝酸银溶液:Cl-+Ag+=AgCl↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 配0.1mol/L的标准盐酸和0.01mol•L-1的标准盐酸 | → | 用0.1mol•L-1的标准盐酸滴定未知Ba(OH)2溶液10mL用去盐酸19.60mL | → | 用Ba(OH)2溶液吸收空气中的CO2 | → | 过 滤 | → | 取滤液20mL,用0.01mol•L-1的盐酸滴定用去盐酸34.8mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是元素周期表中几种短周期主族元素原子半径随原子序数的变化.
如图是元素周期表中几种短周期主族元素原子半径随原子序数的变化.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2或N2O4的浓度不再变化 | B. | c(NO2)=c(N2O4) | ||
| C. | v正(NO2)=v逆(N2O4) | D. | NO2、N2O4的总质量不再变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com