
| 电离能 | I1 | I2 | I3 | I4 | … |
| Im/kJ•mol-1 | 578 | 1 817 | 2 745 | 11 578 | … |
| A. | N | B. | Al | C. | Si | D. | Zn |
科目:高中化学 来源: 题型:选择题
| A. | 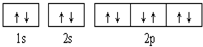 可表示单核10电子粒子基态时电子排布 可表示单核10电子粒子基态时电子排布 | |
| B. | 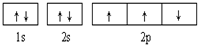 此图错误,违背了泡利原理 此图错误,违背了泡利原理 | |
| C. | 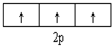 表示基态N原子的价电子排布 表示基态N原子的价电子排布 | |
| D. |  表示处于激发态的B的电子排布图 表示处于激发态的B的电子排布图 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
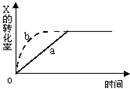 图中a曲线表示一定条件下可逆反应:X(g)+Y(g)?2Z(g)+W(s),△H<0的反应过程,若使 a曲线变为b曲线,可采用的措施是( )
图中a曲线表示一定条件下可逆反应:X(g)+Y(g)?2Z(g)+W(s),△H<0的反应过程,若使 a曲线变为b曲线,可采用的措施是( )| A. | 增大体积 | B. | 增大Y的浓度 | C. | 缩小体积 | D. | 降低温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,与B的离子具有相同电子数的微粒中,有一种分子可与盐酸化合生成一种盐,该反应的化学方程式是NH3+HCl═NH4Cl;
,与B的离子具有相同电子数的微粒中,有一种分子可与盐酸化合生成一种盐,该反应的化学方程式是NH3+HCl═NH4Cl; ,周期表中与C上下相邻的同主族元素形成的气态氢化物中,稳定性最强的是HF(填氢化物化学式).
,周期表中与C上下相邻的同主族元素形成的气态氢化物中,稳定性最强的是HF(填氢化物化学式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
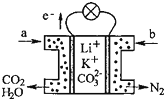 某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理见如图.下列说法正确的是( )
某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理见如图.下列说法正确的是( )| A. | 此电池在常温时也能工作 | |
| B. | 正极电极反应式为:O2+2CO2+4e-=2CO32- | |
| C. | CO32-向正极移动 | |
| D. | a为CH4,b为CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一般碳碳σ键比π键重叠程度大,形成的共价键强 | |
| B. | 分子中含有共价键,则至少含有一个σ键 | |
| C. | 在气体单质中,一定有σ键,可能有π键 | |
| D. | CH4分子中的碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个C-H σ键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
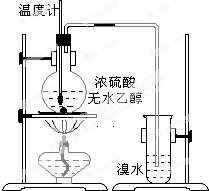 为探究实验室制乙烯及乙烯和溴水的加成反应.甲同学设计了如图所示的实验装置,并进行了实验.当温度升至170℃左右时,有大量气体产生,产生的气体通入溴水中,溴水的颜色迅速褪去.甲同学认为达到了实验目的.
为探究实验室制乙烯及乙烯和溴水的加成反应.甲同学设计了如图所示的实验装置,并进行了实验.当温度升至170℃左右时,有大量气体产生,产生的气体通入溴水中,溴水的颜色迅速褪去.甲同学认为达到了实验目的.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com