

| A. | 加热煮沸的主要目的是除去溶液中溶解的氧气 | |
| B. | 稀释过程中用到的玻璃仪器主要有烧杯、玻璃棒、胶头滴管 | |
| C. | 滴定过程中可用淀粉溶液作指示剂 | |
| D. | 铁矿石中铁的质量分数为70% |
分析 由测定实验流程可知,铁矿石与硫酸反应生成滤液A含硫酸亚铁(可能含硫酸铁),与氯气发生氧化还原反应,将亚铁离子氧化,则B中含铁离子,稀释后,利用铁离子与碘离子发生氧化还原反应测定,以此来解答.
解答 解:由测定实验流程可知,铁矿石与硫酸反应生成滤液A含硫酸亚铁(可能含硫酸铁),与氯气发生氧化还原反应,将亚铁离子氧化,则B中含铁离子,稀释后,利用铁离子与碘离子发生氧化还原反应测定,
A.加热煮沸的主要目的是除去过量的氯气,防止氯气与KI反应,故A错误;
B.稀释过程中用到的玻璃仪器主要有烧杯、玻璃棒、量筒,故B错误;
C.铁离子与碘离子发生氧化还原反应,利用淀粉作指示剂,滴定终点时变为蓝色,且30s不变色,故C正确;
D.若A中只含亚铁,由2I-+2Fe3+=2Fe2++I2及铁元素守恒可知,铁的质量分数为$\frac{0.02L×0.5mol/L×\frac{250}{20}×56g/mol}{10.0g}$×100%=70%,因矿石中可能含铁离子、亚铁离子,则铁矿石中铁的质量分数大于70%,故D错误;
故选C.
点评 本题考查混合物分离提纯的综合应用及含量测定,为高频考点,把握混合物分离流程、分离方法及发生的反应等为解答的关键,侧重分析与应用能力的考查,选项D为易错点,题目难度不大.


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
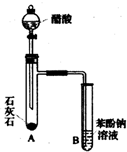 有机化合物分子中的基团之间存在着相互影响.
有机化合物分子中的基团之间存在着相互影响.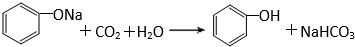 .
.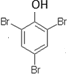 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
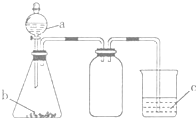 利用如图所示的仪器和药品(必要时可加热),能够达到实验目的是( )
利用如图所示的仪器和药品(必要时可加热),能够达到实验目的是( )| 试剂a | 试剂b | 试剂c | 实验目的 | |
| ① | 盐溶液X | NaOH | 酚酞 | 证明X中含有NH4+ |
| ② | 浓盐酸 | CaCO3 | Na2SiO3溶液 | 证明酸性: HCl>H2CO3>H2SiO3 |
| ③ | 浓盐酸 | MnO2 | 淀粉KI溶液 | 证明氧化性: MnO2>C12>I2 |
| ④ | 浓硫酸 | C | 澄清石灰水 | 证明产物中含有CO2 |
| A. | ①②③ | B. | ①③ | C. | ②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li-Al在电池中作为负极材料,该材料中Li的化合价为+1价 | |
| B. | 用水作电解质溶液 | |
| C. | 该电池的电池反应式为:2Li+FeS═Li2S+Fe | |
| D. | 充电时,阴极发生的电极反应式为:Li2S+Fe-2e-═2Li++FeS |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al原子的最外层电子数依次增多 | |
| B. | Si、P、S元素的最高正价依次升高 | |
| C. | C、N、O的原子半径依次增大 | |
| D. | Li、Na、K的金属性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在汽车排气管上加装“催化转化器”可以减少有害气体的排放 | |
| B. | “84消毒液”具有强氧化性,可做环境的消毒剂从而预防流感 | |
| C. | PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为“细颗粒物“,PM2.5在空气中有可能形成胶体 | |
| D. | 碳酸钡、碳酸氢钠、氢氧化铝均可作为抗胃酸药物使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | ① | ② | ③ | ④ |
| 装置 | 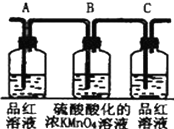 | 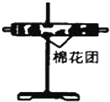 |  |  |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 非血红素铁是食物中铁存在的形式之一,主要是三价铁与蛋白质和羧酸结合成络合物.
非血红素铁是食物中铁存在的形式之一,主要是三价铁与蛋白质和羧酸结合成络合物.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com