
����Ŀ����������(Na2FeO4)��һ�ָ�Ч������ˮ����������ҵ�Ͽ������з����Ƶã�Fe2O3+3Na2O2![]() 2Na2FeO4+Na2O�����й��ڸ÷�Ӧ��˵������ȷ���ǣ� ��
2Na2FeO4+Na2O�����й��ڸ÷�Ӧ��˵������ȷ���ǣ� ��
A.��Ӧ��Na2O2�������������ǻ�ԭ��
B.Fe2O3����ͨ����˿��������ȼ���Ƶ�
C.����1molNa2FeO4����3mol����ת��
D.��Na2FeO4��FeΪ+4�ۣ�����ǿ�����ԣ���ɱ������

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ���Ӧ�ķ���ʽ�����ϵ���
A.��20.0 g NaOH��ϡ��Һ��ϡ������ȫ�кͣ��ų�28.7 kJ��������ϡ�����ϡNaOH��Һ��Ӧ���Ȼ�ѧ����ʽΪ��NaOH(aq)��CH3COOH(aq)=CH3COONa(aq)��H2O(l) ��H��-57.4 kJ��mol��1
B.��NO2������������ˮ�У���ɫ��dz��2NO2(g)(����ɫ)![]() N2O4 (g)(��ɫ) ��H��0
N2O4 (g)(��ɫ) ��H��0
C.�����ȼ����Ϊ��890.3 kJ��mol��1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��CH4(g)��2O2(g)��CO2(g)+2H2O(g)��H����890.3 kJ��mol-1
D.�����������Һ��ϡ�����ϳ��ֻ��ǣ�S2O32-��2H+��S����SO2 ����H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʱ�ӷ�Ӧ����Ӧ�ṩ�����˿�����ʾʵ�飬Ҳ��һ����Ծ���о����ⶨ��![]() Ũ�Ⱥ�С�ĵ⻯����Һʱ��������Ӧ���л�ѧ�Ŵ������ԭ��Һ�е����ӵ�Ũ�ȣ���Ҫ������
Ũ�Ⱥ�С�ĵ⻯����Һʱ��������Ӧ���л�ѧ�Ŵ������ԭ��Һ�е����ӵ�Ũ�ȣ���Ҫ������
����������Һ�У����彫������![]() ������
������![]() �������������ȥ
�������������ȥ
���ټ�������ĵ⻯�أ������������£�ʹ![]() ��ȫת����
��ȫת����![]()
�۽��������ɵĵ���ȫ��ȡ�����½��仹ԭ��![]() ������ʽΪ
������ʽΪ![]()
�ܽ����ɵ�![]() ��ȡ��ˮ�����
��ȡ��ˮ�����![]() ������
������
�ݽ��ܵõ�����Һ����������KI��Һ�����������ữ
���ݷ�Ӧ�����Һ�Ե�����ָʾ������![]() ����Һ�ζ�������ʽΪ��
����Һ�ζ�������ʽΪ��![]()
���������Ŵ������Һ��![]() Ũ�ȷŴ�Ϊԭ��Һ��
Ũ�ȷŴ�Ϊԭ��Һ��![]() Ũ�ȵģ���Ŵ�ǰ����Һ�����ȣ�
Ũ�ȵģ���Ŵ�ǰ����Һ�����ȣ�
A.2��B.4��C.6��D.36��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶�ʱ�����ݻ�Ϊ 2 L ���ܱ������г���һ������ SO2(g)�� O2(g)��������Ӧ��2SO2(g)+ O2(g)2SO3(g) ��H = - 196 kJ/mol��һ��ʱ���Ӧ�ﵽƽ��״̬����Ӧ�����вⶨ�IJ������������ʾ��
��Ӧʱ��/min | n(SO2)/mol | n(O2)/mol |
0 | 2 | 1 |
5 | 1.2 | |
10 | 0.4 | |
15 | 0.8 |
����˵������ȷ����
A.ǰ 5 min ��ƽ����Ӧ����Ϊv(SO2) = 0.08 mol/(L��min)
B.�����¶Ȳ��䣬��ƽ�����������ٳ��� 0.2 mol SO2(g)�� 0.2 mol SO3(g)ʱ�� v�� > v��
C.���������������䣬����ʼʱ�������г��� 2 mol SO3(g)���ﵽƽ��״̬ʱ���� 78.4 kJ������
D.��ͬ�����£���ʼʱ�������г��� 1.5 mol SO3(g)���ﵽƽ��״̬ʱ SO3 ��ת����Ϊ 40%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С��������װ���Ʊ��屽������˵���������
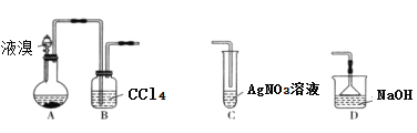
A. װ��A�г��������ܽ��������������ã�װ��B�е�ʵ��������CCl4����ɫ���ɫ
B. ��װ��B������װ��C��װ��C�����ɵ���ɫ��������֤��װ��A�з���ȡ����Ӧ
C. ��װ��B������װ��D����װ��D������������β��
D. ��Ӧ���װ��A�м���NaOH��Һ�����ã��²�Ϊ��ɫ��״Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���û�ѧ������
��1��С�մ������ֽ⣬��ѧ����ʽΪ__��
��2���������Ż�����ˮ���������ӷ���ʽ������ԭ��__��
��3����ҵ������������ʯ���Ʊ�Ư�ۣ���ѧ����ʽΪ__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ��![]() ��
��![]() ��
��![]() �����ڱ��е����λ����ͼ��ʾ����֪
�����ڱ��е����λ����ͼ��ʾ����֪![]() Ԫ��ԭ�ӵ���Χ�����Ų�ʽΪ
Ԫ��ԭ�ӵ���Χ�����Ų�ʽΪ![]() ��������˵������ȷ���ǣ� ��
��������˵������ȷ���ǣ� ��
A.![]() Ԫ��ԭ�ӵļ۵����Ų�ʽΪ
Ԫ��ԭ�ӵļ۵����Ų�ʽΪ![]()
B.![]() Ԫ����Ԫ�����ڱ��ĵ������ڵڢ�A��
Ԫ����Ԫ�����ڱ��ĵ������ڵڢ�A��
C.![]() Ԫ�����������������ǽ���Ԫ�����
Ԫ�����������������ǽ���Ԫ�����
D.![]() Ԫ��ԭ�ӵĺ�������Ų�ʽΪ
Ԫ��ԭ�ӵĺ�������Ų�ʽΪ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��B��C��D����Ԫ�أ���ԭ������������������������С��18��AԪ��ԭ�ӵ������ֻ��1�����ӣ���Ԫ����������N3����������Ų���ͬ��BԪ��ԭ�Ӻ��������Ͼ��ɵ����ӣ�CԪ��ԭ�ӵļ۵����Ų�Ϊns2np2��D���ĺ�����ӹ�����Ar��ͬ��
(1)д��A��C��D��Ԫ�ط��ţ�A________��C________��D________��
(2)д��BԪ�ص��ӵĵ����Ų�ʽ________��DԪ�ص��ӵĵ����Ų�ͼ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ȼ��ȼ��ʱ���ڸ�������������������Ӧ����� NOx ���壬NOx �������ǿ�����Ա�о�����Ҫ���⡣
(1)ͨ�����ϲ�� N2(g)+O2(g)2NO(g)��H��Ӧ�¶Ȳ�ƽ�ⳣ���Ĺ�ϵ���±���
��Ӧ�¶�/�� | 1538 | 2404 |
ƽ�ⳣ�� |
|
|
����H___________________0(����<����>������=��)
(2)�� 800��ʱ����� 2NO(g)+O2(g) 2NO2(g)�ķ�Ӧ���ʲ���Ӧ��Ũ�ȵĹ�ϵ���±���ʾ
��ʼŨ��/ | ��ʼ����/ | |
C0(NO) | C0(O2) | |
0.01 | 0.01 |
|
0.01 | 0.02 |
|
0.03 | 0.02 |
|
��֪��Ӧ���ʹ�ʽΪ V ����K ����c m(NO)cn(O2)���� m��___________________�� K ��=___________________L2mol-2s-1
(3)��ij�¶���(����)��������ɱ�������г��� NO2 ���壬������Ӧ 2NO2(g) N2O4(g)�������ѹ��ʱ��ı仯��ϵ��ͼ

�ٸ÷�Ӧ��ѹ��ƽ�ⳣ�� KP��___________________��
��4s ʱѹ������(�����������Բ���)ʹ���������Ϊԭ����� 1/2��6s ʱ���´ﵽƽ�⣬��P(N2O4)=___________________kPa��
(4)ijѧϰС������ͼ 2 װ��̽��������β��������������Һ����������������װ�ù���ʱ��NO2 �� b �缫�ϵĵ缫��ӦʽΪ___________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com