
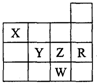
 右图为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
右图为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )| A、常压下五种元素的单质中W单质的沸点最高 | B、Z元素的最高价氧化物的水化物酸性最强 | C、X的氢化物比同族元素的氢化物沸点低 | D、Y、Z和W的阴离子半径依次增大 |


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
| 元素 | Mn | Fe | |
| 电离能 ( kJ?mol-1) |
I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
右图表示元素周期表前四周期的一部分,关于元素X、Y、Z、W的叙述正确的是 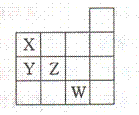
①x、Y的最高价氧化物的水化物酸性为Y<X
②Y、z的气态氢化物的稳定性Y<Z
③W的单质常温下呈液态,可与铁粉反应
④W的原子序数比Z大9
A.只有③ B.①②
C.①②③ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
右图为元素周期表前四周期的一部分,且X、Y、Z、R和W为主族元素.下列说法正确的是 ( )
| X | |||
| Y | Z | R | |
| W |
A.Y单质一定既能与盐酸又能与氢氧化钠溶液反应
B.五种元素的原子最外层电子数一定都大于2
C.单质X的熔点一定比单质Z的熔点高
D.R的最高价氧化物对应的水化物一定是强酸
查看答案和解析>>
科目:高中化学 来源:2010年辽宁省开原市六校2011届高三上学期第一次联考(化学) 题型:单选题
右图为元素周期表前四周期的一部分,且X、Y、Z、R和W为主族元素.下列说法正确的是 ( )
| | X | | | ||||
| Y | Z | R | | ||||
| | | | W
查看答案和解析>> 同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |