
【题目】某混合溶液中所含离子的浓度如下表,则M离子可能为
所含离子 | Cl- | SO42- | H+ | M |
浓度/(mol·L-1) | 2 | 1 | 2 | 1 |
A.Na+
B.Ba2+
C.NO3-
D.Mg2+
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 室温下,不能将浓硫酸盛放在铁桶中
B. 现在“点石成金”术石墨变成金刚石属于物理变化
C. 配制溶液定容时,仰视容量瓶刻度线,所配溶液浓度偏高
D. 工业上冶炼铝时加入冰晶石的作用是降低氧化铝的熔融温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Zn2+的4s轨道和4p轨道可以形成sp3杂化轨道,那么[ZnCl4]2-的立体构型为
A.直线形 B.平面正方形 C.正四面体形 D.正八面体形
答
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为2.0L的的恒容密闭容器中发生如下反应:PCl5(g)![]() PCl3(g)+Cl2(g)
PCl3(g)+Cl2(g)
编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | 达到平衡所需时(s) | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t1 |
Ⅱ | 320 | 0.80 | t2 | ||
Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t3 |
下列说法正确的是
A.平衡常数K:容器Ⅱ>容器Ⅲ
B.反应到达平衡时,PCl5的转化率:容器Ⅱ>容器Ⅰ
C.反应到达平衡时,容器I中的平均速率为v(PCl5)=0.1/t1 mol/(L·s)
D.起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl3 0.45 mol和Cl2 0.10 mol,则反应将向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100mL该条件下的CaSO4饱和溶液中,加入400 mL 0.01 mol/L的Na2SO4溶液,针对此过程的下列叙述正确的是
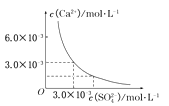
A.溶液中析出CaSO4固体沉淀,最终溶液中c(SO42-)较原来大
B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42-)都变小
C.溶液中析出CaSO4固体沉淀,溶液中c(Ca2+)、c(SO42-)都变小
D.溶液中无沉淀析出,但最终溶液中c(SO42-)较原来大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是
A.已知 P(s,白磷) =P(s,红磷) ΔH<0,则白磷比红磷稳定
B.已知 2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为 241.8 kJ·mol-1
C.已知 2C(s)+2O2(g)=2CO2(g) ΔH=a 2C(s)+O2(g)=2CO(g) ΔH=b,则 a>b
D.已知 NaOH(aq)+HCl(aq)= NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含 40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ 的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属及其合金的说法不正确的是( )
A.目前我国流通的硬币是由合金材料制造的
B.镁在空气中燃烧发出耀眼的白光,可用于制作照明弹
C.出土的古代铜制品表面覆盖着铜绿其主要成分为 CuO
D.日用铝制品表面覆盖着氧化膜,对内部金属起保护作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用浓盐酸与二氧化锰反应制取氯气,下列有关说法中正确的是(气体体积在.标况下测定)( )
A. 若提供0.4 mol HCl,MnO2过量,则可制得氯气4.48 L
B. 若提供0.4 mol HCl,MnO2过量,则转移电子数一定为0.1mol
C. 若有0.4 mol HCl参加反应,则可制得氯气2.24 L
D. 若有0.4 mol HCl被氧化,则可制得氯气2.24 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质可用分液漏斗分离的正确组合是 ( )
①乙醇和乙酸 ②葡萄糖溶液和蔗糖溶液 ③苯和食盐水
④苯和苯酚 ⑤乙酸乙酯和乙醇 ⑥甲酸乙酯和饱和纯碱溶液
A. ③⑥ B. ①③④⑥ C. ①②④⑥ D. ③⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com