
分析 根据物质的量浓度c=$\frac{1000ρω}{M}$计算出质量分数为36.5%、密度为1.18g/mL的浓盐酸的物质的量浓度.
解答 解:盐酸的质量分数为36.5%、密度为1.18g/mL,
则该盐酸的物质的量浓度为:c=$\frac{1000ρω}{M}$=$\frac{1000×36.5%×1.18}{36.5}$mol/L=11.8mol/L,
答:36.5%浓盐酸(密度为1.18g/ml)的物质的量浓度为11.8mol/L.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的浓度与溶质质量分数的关系为解答关键,注意掌握物质的量浓度的概念及表达式,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ②⑤ | D. | ⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
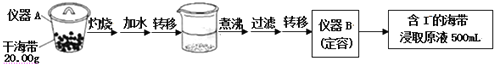
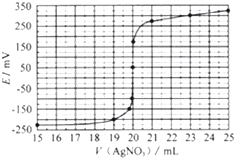
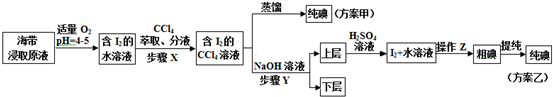
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | OH-、HCO3-、Na+ | B. | Cu2+、NH4+、OH- | C. | Ba2+、K+、NO3- | D. | Ag+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
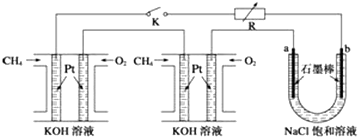
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Pb为正极,发生氧化反应 | B. | SO42-只向正极移动 | ||
| C. | 电解质溶液密度不断减小 | D. | 溶液的pH不断减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发生氧化反应的是H2C2O4 | |
| B. | 离子方程式右侧方框内的产物是H2O | |
| C. | 每消耗6 mol H+,转移5 mol电子 | |
| D. | 还原性:Mn2+<H2C2O4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com