
| A. | 4NA | B. | 3NA | C. | 2NA | D. | NA |
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案科目:高中化学 来源: 题型:选择题
| A. | 金属钠着火燃烧时,用泡沫灭火器灭火 | |
| B. | 凡是给玻璃仪器加热,都要加垫石棉网,以防止仪器炸裂 | |
| C. | 少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗 | |
| D. | 取用化学药品时,应特别注意观察药品包装容器上的安全警示标志 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
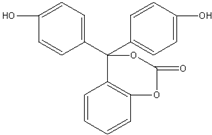 ,下列有关该有机物的说法不正确的是( )
,下列有关该有机物的说法不正确的是( )| A. | 该有机物的化学式为C20H14O5 | |
| B. | 该有机物分子中的三个苯环不可能共平面 | |
| C. | 该有机物可发生加成反应、取代反应、氧化反应 | |
| D. | 1mol该有机物与足量NaOH溶液充分反应,参加反应的NaOH的物质的量为6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)=c(CH3COO-) | |
| B. | 溶液中:c(H+)>c(OH-) | |
| C. | CH3COOH分子的浓度不再变化 | |
| D. | 溶液中同时存在H+、CH3COO-、OH-、CH3COOH、H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2O>NO>N2O5 | B. | NO>N2O>N2O5 | C. | N2O5>NO>N2O | D. | N2O5>N2O>NO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com