
| A. | 氯气作水的杀菌消毒剂 | B. | 硅胶作袋装食品的干燥剂 | ||
| C. | 二氧化硫作纸浆的漂白剂 | D. | 肥皂水作蚊虫叮咬处的清洗剂 |
分析 本题考查学生对物理变化和化学变化的确定.判断一个变化是物理变化还是化学变化,要依据在变化过程中有没有生成其他物质,生成其他物质的是化学变化,没有生成其他物质的是物理变化.
解答 解:A、氯气和水反应生成盐酸和次氯酸,次氯酸具有强氧化性,能杀菌消毒,属于化学变化,故A错误;
B、硅胶做干燥剂是吸水,没有发生化学变化,故B正确;
C、二氧化硫和有色物质化合使之生成无色物质,发生了化学反应,属于化学变化,故C错误;
D、肥皂水显碱性,与蚊虫叮咬处释放的酸发生中和反应,发生了化学反应,故D错误.
故选B.
点评 搞清楚物理变化和化学变化的本质区别是解答本类习题的关键.判断的标准是看在变化中有没有生成其他物质.一般地,物理变化有物质的固、液、气三态变化和物质形状的变化.


科目:高中化学 来源: 题型:选择题
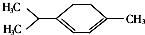 青蒿素是抗疟特效药属于萜类化合物,如图所示有机物也属于萜类化合物,关于该有机物的有关说法正确的是( )
青蒿素是抗疟特效药属于萜类化合物,如图所示有机物也属于萜类化合物,关于该有机物的有关说法正确的是( )| A. | 该有机物的一氯取代物有(不含立体异构)8种 | |
| B. | 该有机物位于同一平面内的碳原子最多有10个 | |
| C. | 该有机物难溶于水,可发生加成、氧化和聚合反应 | |
| D. | 该有机物的最简式为C5H8,与甲苯互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 短周期元素A、B、C、D的原子序数依次增大,它们在元素周期表中的相对位置如图所示,已知C和A的原子序数之差等于A的原子序数,下列说法正确的是( )
短周期元素A、B、C、D的原子序数依次增大,它们在元素周期表中的相对位置如图所示,已知C和A的原子序数之差等于A的原子序数,下列说法正确的是( )| A. | 原子半径:D>C>B>A | |
| B. | 简单离子半径:D>A>B | |
| C. | 简单氢化物的稳定性:D>C>A | |
| D. | 四种元素的最高价氧化物均可溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol•L-1r溶液的pH为2,s通常是难溶于水的混合物.上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol•L-1r溶液的pH为2,s通常是难溶于水的混合物.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 原子半径的大小W<X<Y | B. | 元素的非金属性Z>X>Y | ||
| C. | Y的氢化物常温常压下为液态 | D. | X的最高价氧化物的水化物为强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学性质 | 实际应用 | |
| A | Al2(SO4)3和小苏打反应 | 泡沫灭火器灭火 |
| B | 铁比铜金属性强 | FeCl3腐蚀Cu刻制印刷电路板 |
| C | 次氯酸盐具有氧化性 | 漂白粉漂白织物 |
| D | HF与SiO2反应 | 氢氟酸在玻璃器皿上刻蚀标记 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
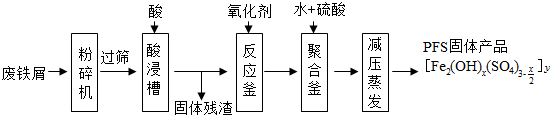
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | |
| A. | 制备Fe(OH)3胶体 | 将NaOH浓溶液滴加到饱和FeCl3溶液中 |
| B. | 由MgCl2溶液制备无水MgCl2 | 将MgCl2溶液加热蒸干 |
| C. | 除去Cu粉中混有的CuO | 加入稀硝酸溶液,过滤、洗涤、干燥 |
| D. | 比较水与乙醇中氢的活泼性 | 分别将少量钠投入到盛有水和乙醇的烧杯中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
| c/(mol•L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
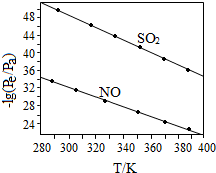
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质水解的最终产物是氨基酸 | |
| B. | 氨基酸和蛋白质遇重金属离子均会变性 | |
| C. | α-氨基丙酸与α-氨基苯丙酸混合物脱水成肽,只生成2种二肽 | |
| D. | 氨基酸溶于过量氢氧化钠溶液中生成的离子,在电场作用下向负极移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com