
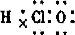
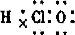


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
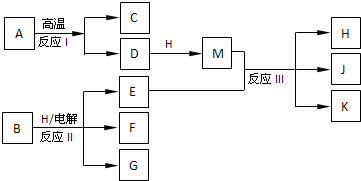
 (2013?安徽模拟)镁_次氯酸盐燃料电池具有比能量高、安全方便等优点,该电池主要工作原理如图所示,其正极反应为:ClO-+H2O+2e-=Cl-+2OH-,关于该电池的叙述正确的是( )
(2013?安徽模拟)镁_次氯酸盐燃料电池具有比能量高、安全方便等优点,该电池主要工作原理如图所示,其正极反应为:ClO-+H2O+2e-=Cl-+2OH-,关于该电池的叙述正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
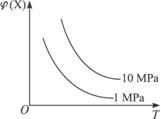
A.2NH3(g)![]() N2(g)+3H2(g)(正反应为吸热反应)
N2(g)+3H2(g)(正反应为吸热反应)
B.H2(g)+I2(g)![]() 2HI(g)(正反应为放热反应)
2HI(g)(正反应为放热反应)
C.4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)(正反应为放热反应)
4NO(g)+6H2O(g)(正反应为放热反应)
D.2SO2(g)+O2(g)![]() 2SO3(正反应为放热反应)
2SO3(正反应为放热反应)
查看答案和解析>>
科目:高中化学 来源: 题型:
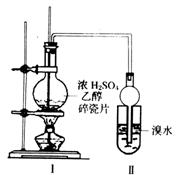 某化学兴趣小组用如图所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性。当温度迅速上升至170℃后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液变为棕黑色。
某化学兴趣小组用如图所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性。当温度迅速上升至170℃后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液变为棕黑色。
(1)甲同学认为:考虑到该混合液反应的复杂性,溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理由正确的是___________。
A.乙烯与溴水易发生取代反应。
B.使溴水褪色的反应,未必是加成反应。
C.使溴水褪色的物质,未必是乙烯。
 (2)乙同学经过细致观察后认为:试管中另一现象可证明反应中有乙烯生成,这个现象是____________________________________________。为确认这一反应是加成反应还是取代反应,可用pH试纸来测试反应后的溶液,理由是_________________________________________________________________________________________________。
(2)乙同学经过细致观察后认为:试管中另一现象可证明反应中有乙烯生成,这个现象是____________________________________________。为确认这一反应是加成反应还是取代反应,可用pH试纸来测试反应后的溶液,理由是_________________________________________________________________________________________________。
(3)丙同学对上述实验装置进行了改进,在I和II之增加如右图装置,则A中的试剂应为_______________,B中的试剂为_______________。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江苏省盐城中学高一(下)期中化学试卷(解析版) 题型:选择题
查看答案和解析>>
科目:高中化学 来源:广东省期中题 题型:填空题
 2NH3(g) ΔH<0 反应中NH3的物质的量浓度的变化的情况如图所示:
2NH3(g) ΔH<0 反应中NH3的物质的量浓度的变化的情况如图所示: 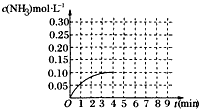
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com