
【题目】研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2—CaO作电解质,利用下图所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中,正确的是
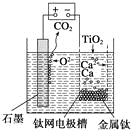
A. 由TiO2制得1 mol金属Ti,理论上外电路转移2 mol电子
B. 阳极的电极反应式为C+2O2--4e-===CO2↑
C. 在制备金属钛前后,整套装置中CaO的总量减少
D. 若用铅蓄电池作该装置的供电电源,“+”接线柱应连接Pb电极
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W、R在元素周期表中的相对位置如图所示,其中R元素的常见单质为气体,下列判断不正确的是( )

A.原子半径:Z>X> Y
B.非金属性:R>W> Z
C.X、Z对应的含氧酸均为强酸
D.Y的最简单氢化物的沸点比X的高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在25℃、 101kP下,1g硫粉完全燃烧放出9kJ的热量,写出表示该反应燃烧热的热化学方程式为__________________________
(2)Cl2和H2O(g))通过灼热的炭层,生成HCl和CO2,当有2mol电子转移时反应释放出145kJ热量,写出该反应的热化学方程式:___________________________ .
(3)已知拆开1molH-H键,1molCl-Cl键,1molH-Cl键,分别需要的能量是436kJ、243kJ、431kJ,则Cl2与H2反应生成HCl的热化学方程式为 _______________________。
(4)已知:C(s)+O2(g) = CO2(g) ΔH=-393 kJ·mol-1
2CO(g)+O2(g) = 2CO2(g) ΔH=-566 kJ·mol-1
写出碳和氧气生成一氧化碳的热化学方程式:___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
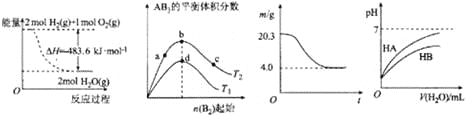
图Ⅰ 图Ⅱ 图Ⅲ 图Ⅳ
A. 图Ⅰ表示H2与O2发生反应过程中的能量变化,则H2的燃烧热△H=-241.8 kJ·mol-1
B. 图Ⅱ表示反应A2 (g)+ 3B2 (g)![]() 2AB3(g),达到平衡时A2的转化率大小为:b>a>c
2AB3(g),达到平衡时A2的转化率大小为:b>a>c
C. 图Ⅲ表示0.1mol MgCl2·6H2O在空气中充分加热时固体质量随时间的变化
D. 图Ⅳ表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH大于同浓度NaB溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.2 mol·L-1的一元酸HA与等浓度NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )

A. HA为强酸
B. 该混合溶液pH=7.0
C. 该混合溶液中:c(A-)+c(Y)=c(Na+)
D. 图中X表示HA,Y表示OH-,Z表示H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中进行反应:2SO2(g)+O2(g) ![]() 2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,当反应达到平衡时,可能存在的数据是( )
2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,当反应达到平衡时,可能存在的数据是( )
A.SO2为0.4 mol·L-1,O2为0.2 mol·L-1B.SO2为0.25 mol·L-1
C.SO2、SO3均为0.15 mol·L-1D.SO3为0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应aA(g)+bB(s)![]() cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是( )
cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是( )

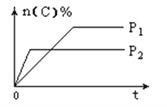
A. 升高温度,平衡向正反应方向移动 B. 使用催化剂,C的物质的量分数增加
C. 化学方程式系数a<c+d D. 根据图象无法确定改变温度后平衡移动方向
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是重要的过渡元素,其单质及化合物具有广泛用途。回答下列问题:
(1)铜元素基态原子的价电子排布式________________________________。
(2)铜能形成多种配合物,如Cu2+与乙二胺(H2N-CH2-CH2-NH2)可形成如图所示配离子。
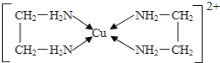
①Cu2+与乙二胺所形成的配离子中含有的化学键是_________________。
a.配位键 b.离子键 c.![]() 键 d.
键 d.![]() 键
键
②乙二胺分子中氮原子的杂化轨道类型为________________________,C、N、H三种元素的电负性由大到小顺序是________________________________。
③乙二胺和三甲胺[N(CH3)3]均属于胺,乙二胺的沸点比三甲胺高很多,原因是_______________。
(3)Cu2+在水溶液中以[Cu(H2O)4]2+形式存在,向含Cu2+的溶液中加入足量氨水,可生成更稳定的[Cu(NH3)4]2+,其原因是_____________________________。(请结合原子的性质进行回答)
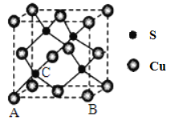
(4)Cu和S形成某种晶体的晶胞如图所示。
①该晶体的化学式为____________________
②该晶胞原子坐标参数A为(0,0,0);B为(1,0,0)。则C原子的坐标参数为____________________。
③已知该晶体的密度为d g·cm-3,Cu2+和S2-的半径分别为a pm和b pm,阿伏加德罗常数值为NA。列式表示该晶体中原子的空间利用率______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫有多种化合物,许多含硫化合物在工业上有重要的用途。
(1)硫化钠(Na2S)俗称硫化碱,常用于印染及制药工业。将硫化钠溶于水,会导致水的电离程度____(该“增大”、“减小”威“不变”);若微热该溶液,pH会___(填“增大”、“减小”或“不变”)。
(2)硫氢化钠(NaHS)常用作有机合成的中间体,其水溶液呈碱性。NaHS溶液中Na+、H+、HS-,OH-离子浓度由大到小的顺序为____。
(3)若向Na2S和Na2SO3的混合溶液中加入足量的稀硫酸溶液,可发生以下反应:
Na2S+Na2SO3+H2SO4→Na2SO4+S↓+H2O(未配平)
①配平化学方程式:__Na2S+__Na2SO3+__H2SO4=__Na2SO4+__S↓+__H2O
②反应中还原产物与氧化产物的物质的量之比是__
(4)室温时,已知H2S的Ka1=1×10-7,Ka2=1×10-13,若只考虑S2-的第一步水解,则 0.1 mol·L-1Na2S溶液pH约__
(5)化工生产中常用FeS作沉淀剂除去工业废水中的Cu2+,其反应原理为:Cu2+(aq)+FeS(s)![]() CuS(s)+Fe2+(aq)。下列有关叙述中正确的是___
CuS(s)+Fe2+(aq)。下列有关叙述中正确的是___
a.Ksp(FeS)<Ksp(CuS)
b.达到平衡时c(Fe2+)=c(Cu2+)
c.溶液中加入少量Na2S固体后,溶液中c(Fe2+)、c(Cu2+)都减小
d.该反应平衡常数![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com